お気軽にお問合せください
(土曜、日曜、祝日、年末年始を除きます)
アルギニンは、老化を防ぎ、若返りと
長寿が期待できます!

まとめ
・現在、老化説(若返り説)として最も有力な説は遺伝子説と摩耗説ですが、これらは全く独立したものではなくお互いに関連性があります。
・遺伝子説とは、寿命や老化や若返りは遺伝子の中に組み込まれているとする説です。遺伝子説として諸説がある中で現在最も注目されているものにテロメア説と長寿遺伝子説があります。テロメア説とは、テロメアの長短が、寿命や老化や老化病と深い関係があるという説です。長寿遺伝子説とは、長寿遺伝子が寿命を延ばし、老化や老化病を抑制したり、ひいては若返りをもたらすとする考えです。長寿遺伝子として現在最も注目されているのにサーチュイン遺伝子があります。
・摩耗説とは簡単に言いますと、体に毒になる物質、特に活性酸素や糖化などによって、体の成分、例えば遺伝子、タンパク質、脂質、糖質などが徐々に傷つけられることによって、細胞や組織や臓器の機能や働きが低下し、寿命の短縮や老化が引き起こされるというものです。
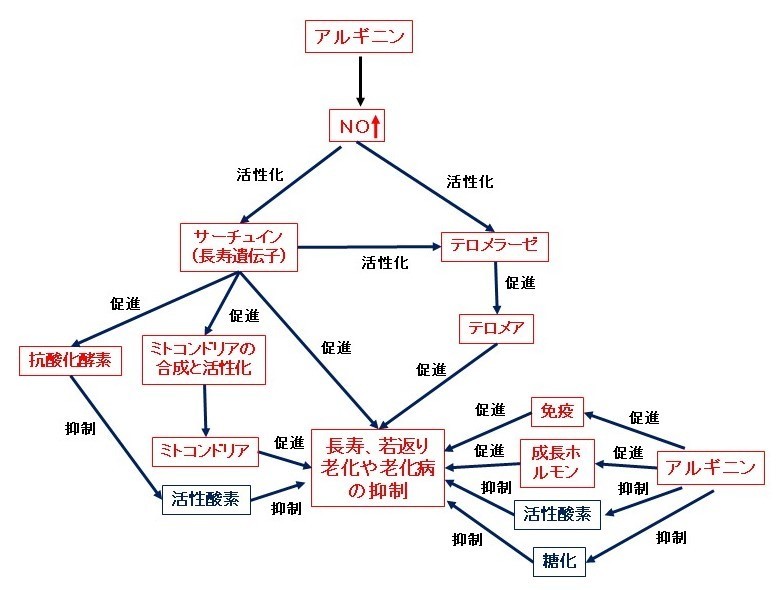
・アルギニン(NO)は、テロメラーゼを活性化し、テロメアを長く保つことで、細胞の老化を防ぎ、寿命延長および老化や老化病の予防や改善をすると考えられます(下図を参照ください)。
・アルギニン(NO)は、長寿遺伝子(サーチュイン、SIRT1)を活性化して、寿命を延長し、老化や老化病を抑制すると考えられます。サーチュインはミトコンドリアの働きを高めます。活性化されたミトコンドリアはエネルギー物質(ブドウ糖、脂肪など)をより多く燃やしてより多くのエネルギー(ATP)を作り身体の活動を活性化します。一方、余分なエネルギー物質(ブドウ糖や脂肪など)は燃やして熱として放出します。また、サーチュインは、抗酸化酵素の生成を促進して、酸化ストレス(活性酸素が過剰な状態)を抑制します。さらにサーチュインはテロメラーゼも活性化します(下図を参照ください)。
・アルギニン(NO)は、体を傷つける活性酸素や糖化を抑制して、老化や老化病を抑制すると考えられます(下図を参照ください)。
・アルギニンは、成長ホルモンの分泌を促進します。成長ホルモンは実際に人を若返らせる現在唯一の方法といわれていますので、アルギニンの摂取によって老化の抑制や若返りが可能になると考えられます(下図を参照ください)。
・アルギニンは、免疫増強作用を示すことで寿命を延長し、老化や老化病を抑制すると考えられます(下図を参照ください)。
・このように、アルギニンは、老化の二大原因と考えられている遺伝子説と摩耗説の両面からアタックすることで、また、成長ホルモン分泌促進作用、免疫増強作用などの働きを示すことで、老化や老化病を強力に抑制し、若返りや長寿が期待できます。
・『アルギニン』は生体成分(体に必要なアミノ酸)です。アルギニンの安全性は高く、副作用の心配はほとんどないと考えられます。実際数多くの臨床試験でアルギニンによると考えられる副作用はほとんどありませんでした。
【図の説明】
アルギニンは長寿や若返り、あるいは老化や老化病を抑制することが期待できますが、そのメカニズムは次のように考えられます。
アルギニンはNOの働きを介して、テロメラーゼを活性化し、テロメアを長く保つことで、細胞の老化を防ぎ、寿命延長および老化や老化病の予防や改善をすると考えられます。
アルギニンはNOの働きを介して、長寿遺伝子(サーチュイン、SIRT1)を活性化します。サーチュインはミトコンドリアの働きを高めることで身体の活動を活性化します。また、サーチュインは、抗酸化酵素の生成を促進して、酸化ストレス(活性酸素が過剰な状態)を抑制します。さらに、サーチュインはテロメラーゼも活性化します。これらの働きで、サーチュインは寿命を延長し、老化や老化病を抑制すると考えられます。
アルギニンは、体を傷つける活性酸素や糖化を抑制して、老化や老化病を抑制すると考えられます。
アルギニンは、成長ホルモンの分泌を促進します。成長ホルモンは実際に人を若返らせる現在唯一の方法といわれていますので、アルギニンの摂取によって老化の抑制や若返りが可能になると考えられます。
アルギニンは、免疫増強作用を示すことで寿命を延長し、老化や老化病を抑制すると考えられます。
このように、アルギニンは画期的な若返り、長寿薬になることが期待できます。
☆老化はどうして起こるか、老化はどうすれば防げるか
ー現在最も有力な老化の原因説と長寿・若返りのための対策法ー
ー120歳以上の長寿と20代への若返りも夢ではないー
「老化とは、年を取ることで体の一部、あるいは各部の働きが衰えることをいい」、最終的にはこれらの働きが停止して死にいたります。
中高年者によく見られる、脂肪太り(特に内臓肥満)、肌荒れ、しみ、しわ、白髪、抜け毛、体力低下、精力低下、記憶力低下などは老化による新陳代謝(体が新しいものに入れかわること)やエネルギー代謝(エネルギーをつくったり消費したりすること)の低下によるものです。また、免疫の低下や動脈硬化は、日本人の三大死因のがん、心疾患、脳卒中の原因となりますが、免疫の低下は免疫系の老化、動脈硬化は血管の老化によります。このように老化は加齢(年を取ること)による体の見かけ上の変化だけでなく、体の中でもいろんな変化が起ってきます。これがある程度蓄積してきますと体の異常や病気という形で現れてきます。40~50歳代以降の中高年の人がかかる病気のほとんどは老化が原因といわれています。そのため、老化を完全に予防したり改善できれば、私たちはほとんどの病気から開放され、がんや心疾患や脳卒中で死ぬこともなくなり、不老長寿も夢ではなくなるのです。
老化はすでに20歳代から始まります。成長が止まったらすぐに老化が待っています。生活習慣の乱れ(食べ過ぎ、飲み過ぎ、無理なダイエット、偏った栄養、喫煙、運動不足、ストレスなど)や紫外線、環境有害物質(食品添加物、環境発がん物質、環境ホルモンなど)などは老化を促進します。
不老長寿は古来人間の究極の夢であり、そのため不老長寿の方法を求めて膨大な努力と研究が行われてきました。しかし、それもほとんど目立った成果はなく、ほとんどが徒労に終わってきました。しかしながら、近年の老化研究における目覚しい進歩のおかげで、現在老化の原因についてもかなり明らかにされてきました(文献1、2、3、4)。
現在老化説(若返り説)として最も有力な説は遺伝子説と摩耗説ですが、これらは全く独立したものではなくお互いに関連性があります。
遺伝子説とは、寿命や老化は遺伝子の中に組み込まれているとするものです。動物の寿命は種によって固有の寿命があります。例えば、人の最大寿命は約120歳で、マウスの最大寿命は3歳以下です。このような種による寿命の違いは遺伝的に決まっています。また、身体の老化現象の多く、例えば、しわ、白髪、薄毛、物忘れなどのほとんどは程度の差はあれ加齢に伴って必然的に出現し、丁度遺伝的にそれぞれがプログラム化されているように見えます(そのためプログラム説とも言います)。また、女性の閉経は、一定の年齢になると全ての女性に起こり、遺伝的にプログラムされています。では遺伝子のどの部分が寿命や老化と関係しているのでしょうか。諸説がある中で現在最も注目されているものにテロメア説(プログラム説の主体)と長寿遺伝子説があります。テロメア説とはテロメアの長さが寿命や老化を制御している(決定している)とする説です。長寿遺伝子説とは長寿遺伝子が寿命を延ばし、老化や老化病を抑制したり、ひいては若返りをもたらすとする考えです。長寿遺伝子として現在最も注目されているのにサーチュイン遺伝子があります。
すなわち、これらの説によれば、テロメアを長くし、サーチュイン遺伝子を活性化する物質があれば、その物質は寿命を延ばし、老化や老化病を抑制したり、ひいては若返りをもたらす可能性が非常に高いことを示しています。
摩耗説とは簡単に言いますと、体に毒になる物質、特に活性酸素などによって、体の成分、例えば遺伝子(核酸)、タンパク質、脂質、糖質などが徐々に傷つけられることによって、細胞や組織や臓器の機能や働きが低下し、老化が引き起こされるというものです。人や動物など生物は有機分子でできていますが、それらは環境因子や体内損傷因子によって絶えず傷つけられています。一方、それを修復する機構が生体には備わっていますが、それは完璧ではなく修復し残した箇所が蓄積し、最終的にそれが生体機能に影響するようになり、老化や老化病を引き起こしたり、死に至ると考えられます。生体を傷つける環境因子としては酸素、放射線、紫外線などがあります。体内損傷因子として代表的なものは酸素から作られる活性酸素です。放射線(X線や自然放射線など)や紫外線は、体に浴びると体内で酸素や水と反応して活性酸素を生成しますので、活性酸素の発生源となります。また、遷移金属イオン(鉄イオンや銅イオンなど)、NADPHオキシダーゼ、ミトコンドリアは活性酸素の主な発生源です。人では1日に消費する酸素の3~5%が活性酸素になると言われていますが、そのうちおよそ90%の活性酸素がミトコンドリアで生成されます。
活性酸素は、反応性が非常に高いために、核酸(DNA、RNA)、タンパク質、脂質、糖質などあらゆる有機化合物と反応し、化学的な変化を加えます。それによって、核酸(DNA、RNA)、タンパク質、脂質、糖質などの構造を変化させ、突然変異を起こしたり、機能を失わせたり、機能を変化させたりします。生体には、変化した有機化合物を除去し、修復するシステムがありますが、それは完璧ではないために、修復し残した変化が蓄積し、それが老化や老化病を引き起こしたり、死に至ると考えられています。
一方、糖化が老化の原因であるとする説があります。タンパク質のアミノ酸のアミノ基や核酸塩基のアミノ基がグルコースなどの還元糖に曝されると、お互いに反応して結合し、それらが化学的に変化して他のタンパク質や核酸と結合し架橋を形成します。このようにして生成した凝集体を糖化反応最終生成物(AGE)といいます。タンパク質の糖化は、タンパク質の機能異常を引き起こしますが、コラーゲン、クリスタリンのような寿命の長いタンパク質で特に影響が大きくなります。核酸の糖化は遺伝子の異常を引き起こし、突然変異や細胞(組織、臓器)の機能障害を引き起こします。糖化はグルコースの濃度が高くなるほど促進されますので、高血糖状態である糖尿病ではその影響が顕著で、糖尿病合併症の主な原因となります。また、AGEの蓄積によって老化や老化病が促進されます。
そのため、活性酸素や糖化を抑制する物質は、老化や老化病を抑制し、若さを保ったり若返ることができると考えられています。
次に、老化説(若返り説)としての遺伝子説と摩耗説についてより詳しく述べます。
遺伝子説とは、寿命や老化は遺伝子に組み込まれているとするものです。動物の寿命は種によって固有の寿命があります。例えば、人の最大寿命は約120歳で、マウスの最大寿命は3歳以下です。このような種による寿命の違いは遺伝的に決まっています。また、身体の老化現象の多く、例えば、しわ、白髪、薄毛、物忘れなどのほとんどは程度の差はあれ加齢に伴って必然的に出現し、丁度遺伝的にそれぞれがプログラムされているように見えます。また、女性の閉経は、一定の年齢になると全ての女性に起こり、遺伝的にプログラムされています。このように、寿命や老化は遺伝的にプログラム化されているという説をプログラム説と言い、その主体がテロメア説です。
一方、遺伝子の中には、それを活性化することで、長寿と老化予防と若返りをもたらすことができる遺伝子があるとする説を長寿遺伝子説と言います。長寿遺伝子として現在最も注目されているものにサーチュイン遺伝子があります。
1-1)テロメア説
テロメア説については、テロメアとテロメラーゼの発見に寄与した3人の科学者に、2009年ノーベル生理学・医学賞が授与されたことで一躍有名になり、マスコミなどに広く取り上げられるようになって、それらに働く成分がさも若返りや長寿の夢の特効薬のように言われたことがあります。このところ世間的にはそのブームも少し覚めた感じがありますが、実際には医学や科学の世界では次々とそれを裏付けるデータも蓄積されてきています。そこで、最新のデータも含め、それを医学的、科学的に検証してみたいと思います(おすすめの本)。
また、アルギニン(NO)はテロメラーゼを活性化し、テロメア長を維持しますが、アルギニンが寿命(生存率)や老化や老化病にどういう働きを示すかについても述べたいと思います。
生物の設計図であるDNAは、例えば私たち人の細胞では46本に分けられ、それぞれ線状の染色体として存在しています。この染色体の末端についているのがテロメアです。テロメアの働きは、一つは染色体末端の保護、もう一つは染色体の末端を完全に複製することです。ところで、テロメアには避けがたい宿命があります。それは細胞分裂に伴ってDNAが複製されるたびに短くなることです。人のテロメアは最初1万~2万塩基対ありますが、細胞が増殖する過程で、1回の細胞分裂あたり100~150塩基対ほど短くなります。テロメアが5000塩基対位まで短くなると細胞は分裂を停止し、細胞は老化しやがて死んでしまいます。このように、組織や臓器に老化細胞が増えていくと、組織や臓器は縮小し、働きも低下し身体全体が老化し人は死んでしまいます。ところで、人の最大寿命は120歳程度と考えられていますが、テロメアの長さから計算した最大寿命とほぼ一致します。ではどうしてほとんどの人は120歳前に死亡するのでしょうか。それは、人のテロメアは長い人と短い人がいるということです(個人差が大きい)。60歳あたりからすでに平均テロメア長が5000塩基対程度になる人もいれば、100歳になっても十分に長いテロメアを持っている人もいます。実際、テロメアが長い人と短い人を比べた場合、テロメアが短い人より長い人の方が長生きするというデータがあります。テロメアが短かった人たちは心臓血管系(3.18倍の死亡率増加)や感染症(8.54倍の死亡率増加)で亡くなる頻度が高かったそうです(文献5、6)。なお疫学研究において、短い白血球のテロメア長(全身のテロメアの長さを反映)と、より高い死亡率、老化の促進および慢性疾患(老化病)(肥満、高脂血症、動脈硬化、心血管病、心不全、2型糖尿病、高血圧、骨粗鬆症など)のより高いリスクとが関連することが報告されています。このことは、テロメアが短くなると老化が促進され、肥満、高脂血症、動脈硬化、心血管病、心不全、2型糖尿病、高血圧、骨粗鬆症などの慢性疾患(老化病)や感染症に罹りやすくなり、死亡率が高くなるものと考えられます。そのため、若さや健康を保つためにはテロメアを長く保つことは極めて重要なこととなります。
【注】最近、慶応大学医学部が、英国のニューカッスル大学との共同研究によって、百寿者(100歳以上)や遺伝的に百歳に到達する確率が高いと考えられる百寿者の直系子孫(血縁のある子供)では、テロメア長がより長く保たれており、実際の年齢が80歳代でも、60歳代の平均値に匹敵する長さを有していることが分かったことを報告しています(百寿者の秘訣:健康寿命を延ばす二つの要因を発見 -1,554 名を対象とする大規模高齢者コホート研究-)。
【おすすめの本】
◎「健康細胞から若返る! テロメア・エフェクト 長寿のための最強プログラム」(NHK出版、2017)(テロメアおよびテロメラーゼに関する研究で、2009年ノーベル医学・生理学賞を受賞したエリザベス・ブラックバーン博士らによって書かれた一般向けの本)。
1-1-1)ストレスによるテロメア短縮とその抑制
しかしながら、最初同じくらいのテロメア長を持っていても寿命は同じとは限りません。それは、テロメアは色々なストレスによっても短くなるということです。ストレスとして、放射線、紫外線や活性酸素などがありますが、これらはゲノムを損傷しテロメアを短縮します。中でも活性酸素によってゲノムは日常的に損傷しテロメアを短縮します〔放射線や紫外線を体に浴びると体内で活性酸素(フリーラジカル)が生成しますが、これが放射線や紫外線による体の傷害の主な原因となります〕。そのため、活性酸素に対し有効な対策を取ることは、テロメア短縮を遅らせ老化を防ぐのに有効と考えられています。
a)抗酸化成分の血中濃度とテロメアの長さとの関係
実際、抗酸化成分の血中濃度とテロメアの長さとの関係を調べた研究があります(文献7)。平均年齢66歳の高齢者(男女786人、オーストリア)について、ビタミンC、ルテイン、ゼアキサンチン、β-クリプトキサンチン、カンタキサンチン、リコペン、ビタミンE、カロテン、レチノールの血中濃度と白血球のテロメアの長さ(全身のテロメアの長さを反映)が測定されました。その結果、ルテイン、ゼアキサンチンおよびビタミンCとテロメア長との間に明らかに正の相関関係がありました。中でもビタミンCが最も相関関係が強力でした。一方、その他の抗酸化成分はテロメア長と相関関係はありませんでした。このことは抗酸化成分、中でも特にビタミンンCがテロメアの長さの維持に保護的効果を有することを示しています。
b)微量栄養素(ビタミン、ミネラルなど)はテロメアの長さにどう影響するか
また、一方、女性(586人。年齢35~74歳。米国)についての疫学研究において、微量栄養素(ビタミン、ミネラルなど)が白血球のテロメア長にどう影響するかが調べられました(文献8)。被験者の65%がマルチビタミン(色んなビタミンやミネラルを万遍なく配合)を摂取していました。そのうち74%がほぼ毎日摂取していました。マルチビタミンを毎日摂取している人は、摂取していない人に比べ、平均5.1%長いテロメアを有していました。この差は約9.8年分のテロメアに相当します。このことは、マルチビタミンを毎日摂取している人は、摂取していない人に比べ、生物学的に約10年若いということになります。この効果は抗酸化剤サプリメント(抗酸化成分を主に配合)でも同様に認められました。このことは、マルチビタミンや抗酸化成分がストレス(活性酸素など)を抑制することでテロメアの短縮を防いだためと考えられます。さらに、食物から摂取した微量栄養素がテロメア長にどういう影響があるかが検討されました。その結果、ビタミンCとビタミンEをより多く摂取している人では明らかに(統計的に有意に)長いテロメアを有していることが示されました。一方、他の微量栄養素はテロメア長と関係ありませんでした。マルチビタミンを摂取していないグループでもビタミンCとビタミンEのより多い摂取はより長いテロメアと関係していました。これらの結果は、ビタミンや抗酸化成分、特にビタミンCは、テロメアの短縮を抑制し、生存率(寿命)を伸ばし、老化を抑制し、慢性疾患(老化病)(動脈硬化、2型糖尿病、高血圧、肥満など)のリスクを低減させることが期待できることを示しています。〔実際、Khawらによれば(Lancet, 357, 657 (2001))、ビタミンCは、全死亡率、心血管病、虚血性心疾患、がんによる死亡率を最大約1/3まで減少させることが報告されています〕。
c)栄養素とテロメアの関係(レビュー)
栄養素とテロメアの関係をまとめた文献があります(文献9)。テロメアの長さは加齢、ストレス、感染症、肥満、慢性病(特に老化病、例えば、メタボリックシンドローム、生活習慣病、アルツハイマー病、パーキンソン病、がんなど)によって短くなることが知られています。加齢の場合は細胞分裂を繰り返したため、ストレス、感染症、慢性病の場合はそれらによって障害を受け消失した細胞を補うために細胞分裂が増加したため、テロメアが短縮していきます。これらの病気の根底には炎症が関与しています。炎症は酸化ストレスを生じます。そのため、炎症や酸化ストレスを軽減する成分はテロメアの短縮を防ぐことができます。テロメアは、健康的なライフスタイルや食事で長く維持されます。また、テロメアの長さを長くするテロメラーゼ(後述)の活性にもライフスタイルや食事が影響することが知られています。この文献では食事の成分(栄養素)がテロメアの長さにどう影響するかについて述べています。
●葉酸(ビタミンB群の一つ)はテロメアの合成に必要ですので、それが不足するとテロメアが短くなります。また、葉酸は体内で還元体になりますが、それが抗酸化作用を示します。加えて、葉酸は、活性酸素を生成し、動脈硬化を引き起こすホモシステインを低下させます。このように、葉酸はその活性酸素抑制作用によってテロメアを活性酸素の害から保護している可能性があります。
●ビタミンB12をサプリメントとして摂取すると、摂取しない場合に比べテロメアが長く維持されることが報告されています(女性)。ビタミンB12は抗酸化活性と抗炎症作用を持っています。そのため、高用量をサプリメントとして摂取した場合、ビタミンB12の抗酸化作用と抗炎症作用がテロメアを長く維持するのに寄与したものと考えられます。
●ニコチンアミド(ナイアシン)(ビタミンB群の一つ)は細胞においてテロメアの短縮を抑制します。ニコチンアミドは活性酸素の生成を抑制します。
●ビタミンAとβ-カロテンは、食事から摂取した場合、テロメア長を長く維持します(女性)。ビタミンAとβ-カロテンの抗酸化活性がテロメア長の維持に寄与したものと考えられます。なお、ビタミンAとβ-カロテンはサプリメントとして摂取した時、死亡リスクを増加させる可能性があるという報告があります(文献10)。また、ビタミンAの過剰摂取は様々な安全性面での問題を生じます(文献11)。β-カロテンの過剰症は特に報告されていませんが、喫煙者(過去喫煙していた人も含め)がサプリメントとしてβ-カロテンを摂取した場合、肺がん、前立腺がん、脳出血、心臓血管病、および死亡のリスクが増加する可能性があります(文献12)。これらのことから、ビタミンAとβ-カロテンは食事から摂ることをおすすめします。サプリメントとして摂ることはおすすめできません。
●ビタミンDの血中濃度と白血球のテロメア長との間に正の相関関係があることが報告されています(女性)。ビタミンDは抗炎症作用を示しますのでこれがテロメアの短縮を防いでいるものと考えられます。
●ビタミンCとビタミンEは良く知られていますように、抗酸化活性を持っています。ビタミンCとビタミンEは、食事として摂取した場合でも、サプリメントとして摂取した場合でも、摂取量に応じてテロメアがより長くなりました(女性)。細胞を用いた試験において、ビタミンCとビタミンEは、通常の場合に比べ、細胞の寿命を数倍伸ばしました。また、細胞の老化を抑制しました。加齢に伴うテロメアの短縮はビタミンCとビタミンEで半分近くまで抑制されました。加齢に伴うテロメラーゼ活性の低下もビタミンCとビタミンEで抑制されました。このことは、活性酸素を消去することによって、活性酸素によるテロメアの短縮とテロメラーゼの活性低下が抑制され、テロメア長を長く保つことで寿命が伸び、老化が抑制されることを示しています。
●マグネシウムは、食事として摂取した場合、テロメア長を長く維持します(女性)。マグネシウムが欠乏した状態を続けると、酸化ストレスが増加し、テロメアは短くなります(ラット、細胞)。
●亜鉛は、テロメラーゼ活性を高めます。高齢者において、テロメアの短縮が限界に達した細胞(細胞分裂できない老化した細胞)の割合や、テロメア長の短縮の程度は、細胞内の亜鉛の減少の程度と関係していました。亜鉛は酸化ストレスを減少させます。このように、亜鉛は酸化ストレスの軽減やテロメラーゼ活性の増加などによってテロメア長に影響する可能性があります。
●鉄は、他の栄養成分と異なり、テロメアを短くします。鉄は活性酸素を生成させ酸化ストレスを増加させます。鉄によるテロメアの短縮は、鉄による活性酸素の生成と酸化ストレスの上昇によるものと考えられます。そのため、病気の治療のために必要な場合を除き、鉄の摂りすぎは控えるべきと考えられます。
●オメガ-3脂肪酸(ドコサヘキサエン酸、エイコサペンタエン酸)の血中濃度とテロメア短縮の軽減の大きさの間に正の相関関係があることが示されています。オメガ-3脂肪酸の血中濃度と、低レベル炎症マーカーと高レベル抗炎症マーカーとが相関していました。また、オメガ-3脂肪酸の摂取は、抗酸化酵素(スーパーオキシドディスムターゼ、カタラーゼ、グルタチオンペルオキシダーゼ)の活性を増強し、寿命を延長しました(マウス)。オメガ-3脂肪酸による抗炎症活性と抗酸化活性が細胞のターンオーバーとDNAの酸化的障害を減少させ、その結果テロメアの短縮を抑制したものと考えられます。
●ブドウ種子とお茶に含まれるポリフェノールは抗炎症活性と抗酸化活性を持つことが報告されています。実際、お茶を習慣的に飲む人は、たまにしか飲まない人に比べ、長いテロメアを有していました(約5年の生存期間の差に相当)。また、ブドウ種子ポリフェノールの摂取はより長いテロメアと相関する傾向が見られました(マウス)。
●ウコンの成分クルクミンはポリフェノールの一種です。クルクミンは抗酸化活性と抗炎症活性を示します。クルクミンを摂取させたとき、DNAの障害が減少し、テロメアの長さがより長く維持される傾向がありました(マウス)。
●抗酸化栄養素として知られているコエンザイムQ10もテロメアを長く維持することが報告されています(ラット)(文献13)。通常のラットおよび酸化ストレスが増加したラットを用いて検討されました。通常のラットにコエンザイムQ10を摂取させると、長いテロメアの割合が増加しました。一方、短いテロメアの割合は減少しました。酸化ストレスの増加したラットでは長いテロメアの割合は通常のラットに比べ減少し、一方、短いテロメアの割合は増加していましたが、コエンザイムQ10を摂取させると、長い部分と短い部分のテロメアの割合はそれぞれ通常ラットのレベルまで回復しました。これは、コエンザイムQ10の抗酸化作用によって、活性酸素によるテロメアの酸化障害が抑制され、テロメア長が長く維持されたものと考えられました。
d)運動とテロメアの関係
一方、ライフスタイルの改善がテロメアを長くすることが知られています。運動は、肥満、高血圧、高脂血症、糖尿病、動脈硬化、アルツハイマー病、骨粗鬆症、がんなどの代謝異常(メタボリックシンドローム)や慢性病を予防・改善し、死亡率を低下させ、健康に良いことは良く知られています。これらの異常や病気は老化と関係があると考えらえています。そのため、運動はテロメアの短縮を抑制する可能性があります。これらを背景に運動とテロメアの長さとの関係を検討した研究があります(文献14)。双子の男女2401人(女性2152人、男性249人。年齢18~81歳。英国)が試験に採用されました。試験者の白血球のテロメアの長さは個人間でかなり差があり、4.9から9.1キロベース(kb)の範囲でした(平均7.0kb)。テロメアの長さは年齢とともに短くなり、年間の平均消失数は21.0ヌクレオチド(b)でした。運動レベルは4段階に分類されました〔運動習慣なし(余暇時間における1週間当たりの平均運動時間16分)、短い運動時間(同36分)、中程度の運動時間(同102分)、長い運動時間(同199分)〕。肥満度(BMI)の増加は運動レベルの減少およびより短いテロメア長と有意に相関していました。余暇時間の運動レベルと平均テロメア長との関係では、運動レベルが増加するにつれて明らかに(統計的に有意に)テロメアが長くなりました。運動習慣なしグループに比べ、長い運動時間グループのテロメアは平均200ヌクレオチド(b)長いことが示されました。この差は9.5年分のテロメアに相当します。このことは、良く運動する人は、運動しない人に比べ、生物学的に約10年若いということになります。これらの結果は、運動による老化や老化病の抑制、あるいは死亡率の低下などの健康効果の少なくとも一部は、運動によるテロメア長の維持効果が関わっているということを示しています。では、運動がどうしてテロメア長の維持効果を示すのでしょうか。適度な運動は体内の抗酸化ストレス能を高めることが知られています。これは運動による酸化ストレスの増加に対抗するために体内の抗酸化システム(抗酸化酵素など)が増強されるためではないかと考えられています(これを運動ホルミシス現象と言います)(文献15)。
では、健康に良い運動とはどのようなものでしょうか。これに対する検討結果が報告されています(文献16)。運動習慣のない健康な人を、3種類の強度の運動に分けました。弱い強度の運動群〔25%VO2max(最大酸素摂取量の25%の強度)〕、中等度の強度の運動群(50%VO2max)、強い強度の運動群(75%VO2max)です。各強度群の被験者は自転車エルゴメーターを使って、1日30分間、週5~7回、12週間、各強度の運動を行いました。運動の健康効果は、アセチルコリン刺激による前腕血流量の増加(血管内皮細胞の働きに異常があるかどうかの指標の一つ。内皮細胞の機能に異常があると、動脈硬化や心血管病を起こすリスクが高くなります。糖尿病、高血圧症などの患者で一般的にみられます。血管内皮細胞からのNOの生成量の増加と関係があります。NOは血管を拡張し、動脈硬化を防ぎます)を指標としました。その結果、中等度の強度の運動群では、アセチルコリン刺激による前腕血流量の増加は50%増強されました。一方、弱い強度の運動群と高い強度の運動群では、アセチルコリン刺激による前腕血流量の増加の増強は見られませんでした。つまり、最大酸素摂取量の半分(50%)の中等度の運動では、運動による健康効果が見られたのに対し、最大酸素摂取量の25%の弱い強度の運動と最大酸素摂取量の75%の高い強度の運動では、運動による健康効果が見られなかったということです。弱い強度の運動では運動の強さが弱いために運動による健康効果がでなかったものと納得できますが、強い強度の運動の場合どうして運動による健康効果が出なかったのでしょう。これを明らかにするために、強い強度の運動の場合の、体内の酸化ストレス(活性酸素)に対する影響が検討されました。その結果、強い強度の運動の場合、体内の酸化ストレスは明らかに(統計的に有意に)上昇しました。一方、弱い強度の運動の場合、体内の酸化ストレスは変化ありませんでした。中等度の運動の場合、体内の酸化ストレスはかえって弱くなる傾向が見られました。このことは、中等度の強度の運動では、運動によって生成した活性酸素は、その刺激によって誘導された抗酸化酵素によって完全に消去され、さらにその抗酸化酵素は元々体内にある活性酸素の一部までも消去したと考えられるのに対し、強い強度の運動では、運動によって生成した活性酸素の量が多すぎて、誘導された抗酸化酵素だけではそれを消去することができなかったため、体内の抗酸化ストレスが上昇したものと考えられます。従って、運動習慣のない健康な人が、健康を維持するため、あるいは病気のリスクを回避するために運動する場合、おすすめする最適な運動の強度は、最大酸素摂取量の半分(50%)位です。運動の強度は弱すぎても効果がないし、強すぎては酸化ストレスによる障害によって病気に罹りやすくなり、寿命も短くなるでしょう。
では、運動とマルチビタミン(抗酸化ビタミンを含んでいます)や抗酸化サプリメントを併用すれば、それぞれの効果が発揮されて、テロメア長はさらに長く維持されるでしょうか。事はそんなに簡単ではないようです。運動と抗酸化サプリメント(ビタミンC+ビタミンE)を併用した場合、抗酸化サプリメントは運動の健康効果を打ち消すことが報告されました(文献17)。ではどうしてそういうことが起こったのでしょうか。適度な運動は適度に活性酸素の産生量を増やします。これによってPGC1α/β、PPARγが誘導されます。PGC1α/βは、体内の抗酸化酵素(スーパーオキシドジスムターゼ(SOD)、グルタチオンペルオキシダーゼ(GPX1)、カタラーゼ)を誘導するとともに、種々の健康効果、例えば、インシュリン感受性の向上などをもたらします。ところが、運動と抗酸化サプリメントを併用すると、運動によって生じた活性酸素が抗酸化サプリメントによって消去されました。それとともに、PGC1α/β、PPARγの誘導はほぼ完全に抑制され、SOD、GPX1などの抗酸化酵素の誘導もほぼ完全に抑制されました。また、種々の健康効果も消失しました。運動と抗酸化サプリメント(やマルチビタミン(抗酸化ビタミンが含まれています))を併用すれば相加的あるいは相乗的な効果が得られるのではないかと考えていた私たちにとってこれらのデータは衝撃的でした。
以上のデータから、運動とマルチビタミンや抗酸化サプリメントが、お互いのテロメア維持効果や健康効果になるべく影響しないで最大限の効果を発揮するようにするには、例えば、運動習慣のない人ではマルチビタミンや抗酸化サプリメントを毎日摂取することがテロメア長の維持や健康を保つには重要と考えられます。一方、運動習慣のある人では運動日はマルチビタミンや抗酸化サプリメントの摂取は止めたほうがよいでしょう。運動日でない日は摂取したほうがよいと思われます。ただ、激しい運動をする人は活性酸素の発生が体内の抗酸化システムの能力を上回り、酸化障害を起こす可能性がありますのでマルチビタミンや抗酸化サプリメントの積極的な摂取をおすすめします。抗酸化成分としてビタミンEを用いる場合はその摂取量に気を付けてください。ビタミンEは1日に150IU(100mg)を超えた量を摂取すると死亡率が増えるというメタアナリシスの結果が報告されています(文献18)。この理由として、大量のビタミンEが存在すると、ビタミンEと活性酸素が反応して生成するビタミンEラジカルの量が増え、これがプロオキシダント(酸化促進物質)となって傷害を引き起こすためと考えられています。そのため、おすすめするビタミンEの摂取量は1日150IU(100mg)以下です。それを超えた量ですと長期間の摂取で死亡率が増加する可能性があります。
1-1-2)テロメラーゼとその活性化
一方、テロメアはテロメラーゼという酵素によって伸ばすことができます。テロメラーゼは人では生殖細胞や幹細胞(多能性幹細胞)に高い活性が検出されますが、その他の体細胞のほとんどに活性が認められません。ただ、組織幹細胞〔皮膚や血液や肝臓のようなきまった組織や臓器で、消失したり死滅したりして細胞が足りなくなった時それを補うために新しい細胞を作り続けている幹細胞。例えば、骨髄には造血幹細胞があり赤血球や白血球などの血液細胞を作っています。また、皮膚や肝臓では細胞が次々と作られたり再生するのも、骨折が治るのも、髪の毛が伸びるのもこの組織幹細胞の働き(自己複製能)のおかげです。現在、神経、上皮、心筋、肝、消化管上皮、生殖、造血、間葉系、骨格筋など様々な場所に見つかっています〕には弱いテロメラーゼ活性が発現していて、細胞分裂ごとのテロメア短縮を抑制し一生を通じて多くの細胞を供給できますが、テロメラーゼ活性が弱く、年齢とともに徐々にテロメアが短縮し、結局細胞は老化します。このことは、これら組織幹細胞に見られるテロメラーゼ活性は、テロメア短縮による細胞老化を防ぐことができないほど不十分であり、機能細胞を供給し続けられないということです。また、細胞の老化とともにテロメラーゼ活性が低下するとの報告もあります。これらのことから、組織幹細胞の弱いテロメラーゼ活性をより強くすることで、老化防止や若返り、はては120歳以上の長寿を達成しようという試みが盛んにおこなわれています。他方、テロメラーゼはがん細胞の多くに高い活性が示され、それががん細胞に無限増殖性を与えていることが考えられます。しかしながら、最近の研究で、テロメラーゼの活性化だけでは細胞はがん化(造腫瘍性)しないことが示されていますが、完全にその懸念を払拭するまでには至っていません(文献6)。そのため、現在は、テロメラーゼ活性を自在に発現調節できる方法や成分の開発が試みられています。
a)テロメラーゼの再活性化によって若返ることができる!
テロメラーゼの活性化が若返りの特効薬になりうる可能性を示した研究があります(文献19)。ハーバード大学医学部のJaskelioffらが行った研究で、テロメラーゼ活性を失くしたマウスでは、機能障害を起こした短いテロメアを示し、細胞は5~6回の継代培養後分裂を停止し、老化した細胞の形態を示しました。つまり細胞はほとんど分裂しない静止状態になりました。また、DNA損傷の増加、種々の組織の機能低下、特に増殖性の高い組織、例えば生殖細胞のアポトーシスによる極度の精巣萎縮と睾丸サイズの減少とそれによる生殖能力の低下、顕著な脾臓の機能低下、クリプト細胞のアポトーシスに伴う腸陰窩の減少と絨毛の退化、脳における神経幹細胞の自己複製能の減少や神経細胞増殖能の低下などによる脳重量の減少、嗅覚減退など老化したマウスに見られる現象が見られました。また、テロメラーゼの活性を失くしたマウスではそうでないマウスに比べ寿命がほぼ半分に短縮しました。一方、このマウスの細胞にテロメラーゼが再活性化されるような処置を行うと、テロメアは長くなり、細胞は分裂増殖を再開し、さらに8回以上の継代培養後も分裂し続けました。さらにこのマウスではテロメラーゼ再活性化後わずか4週間後に、組織や臓器の若返りが見られました。精巣の生殖細胞のアポトーシスの減少による正常な精巣サイズへの回復と生殖能力の増加、脾臓重量の回復、腸クリプト細胞のアポトーシスの減少が見られました。また、脳においては神経幹細胞の自己複製能の回復や神経細胞増殖能の正常化、脳重量の回復などが見られました。嗅覚に関してはほぼ正常レベルまで回復しました。このマウスでは寿命も延長しました。
人の典型的な老化現象には、白髪、皮膚の弾力の低下としわ、視力の低下、聴力の低下、嗅覚の低下、筋力の低下、骨折しやすくなる、血管の老化(動脈硬化など)、性機能の低下、記憶力の低下などが見られますが、これらはほとんどがテロメアの短縮による組織幹細胞の機能低下が原因で、新しい細胞が供給されにくくなったためと考えられます。Jaskelioffらによる上記研究では、テロメラーゼ活性の消失によるテロメアの短縮により増殖停止状態(老化状態)にある組織幹細胞が、テロメラーゼの再活性化によりテロメア長を回復し、増殖能を回復して、細胞や組織や臓器の若返りが起こったものと考えられます。このことから、人においても、テロメラーゼの活性化によるテロメアの伸長や、ストレスなどによるテロメア短縮の抑制などによりテロメア長を長く保つことができれば、120歳以上の長寿や、本当の意味での若返り(細胞、組織、臓器および身体全体の若返り)が可能になるのではないかと考えられます。
では、人の場合、テロメラーゼはどうすれば活性化できるのでしょうか。人では遺伝子工学的にテロメラーゼを活性化することは現在のところほとんど不可能ですし、がん化の危険もあります。そのため、生体物質や人間が昔から摂取してきてがん化の危険がない物質を摂取することでテロメラーゼを活性化できれば理想的です。実はそのような物質がいくつか見出されてきています。そのような物質をうまく摂取することで長寿や若返りができたらすごく素敵ですしワクワクしますよね!一方、ライフスタイルを工夫することでもテロメラーゼが活性化されることが知られています。
b)食生活とテロメラーゼ活性の関係
先ず、ライフスタイルがテロメラーゼにどういう影響を及ぼすかについて見てみましょう。食事の違いが健康や寿命に大きくかかわることは良く知られています。日本食が健康に良く、日本人の長寿命に寄与しているとか言われています。一方、地中海食の健康効果もよく知られています。地中海食は健康に最も良い食事の一つと言われています。10年間の追跡調査によって、地中海食をよく食べる人は、そうでない人に比べ、死亡率が低く、心血管病やがんによる死亡率が低下しました(文献20)。また、脂質代謝、血管拡張性、糖質代謝、抗酸化ストレス能など心血管病の危険因子に対して良い効果を示します。さらに、地中海食はより長い寿命と健康寿命をもたらすことが示されています。また、細胞を酸化ストレスから守り、細胞の老化や細胞死(アポトーシス)を防ぎ、テロメアの短縮を抑制することが示されました。
ではどの程度地中海食を食べればテロメア長の維持や健康効果に結び付くのでしょうか。さらに地中海食はテロメラーゼの活性に影響するのでしょうか。これらを明らかにするため検討がなされました(文献21)。217人の白人(イタリア住人)の男女(平均年齢77.9歳)が試験に登録されました。白血球のテロメアの長さは年齢とともに減少しました。1年年を取るごとにテロメアは58塩基(b)だけ短くなりました。年齢とは関係なく、女性のほうが男性より長いテロメアを持っていました。その差は330bでしたので、女性は男性より生物学的に5.7年若いということになります。なお、イタリア人の平均寿命(2012年)は男性80歳、女性85歳ですので(文献22)、テロメアの長さの差から計算した年齢差とほぼ一致しました。このことから、テロメアの長さを測ることによって余命を調べることができるかもしれません。実際、テロメアの長さを測って余命を推測しようという試みはすでに色々行われています(文献23)。次に、喫煙とテロメアの関係が調べられました。そうしますと、喫煙者では、非喫煙者に比べ、テロメアは490b短縮していました。これは、喫煙者は非喫煙者に比べ8.4年生物学的に老化しているということになります。ところが過去喫煙歴があっても禁煙することによってテロメアは長く維持されることが示されました(喫煙歴があるが現在喫煙していない人では、非喫煙者と比べ、テロメアは60b短かっただけでした)。白血球のテロメアの長さとテロメラーゼ(PBMC)活性との間には有意な正の関係がありました。このことは、テロメアの長さの少なくとも一部はテロメラーゼの働きによるものと言えます。
被験者は、地中海食をどの程度摂取したかによって分類されました。分類は地中海食スコア(MDS)に従って3分類に分けました。第一分類は低スコア群(MDSが3以下)、第二分類は中スコア群(MDSが4~5)、第三分類は高スコア群(MDSが6以上)です。MDSとは、食物群を9分類し、男女別の摂取量の中央値を計算し、各食物群の摂取量が中央値より多いか少ないかでスコア化したものです。有益と考えられる食物群(野菜、マメ科植物、果実、穀物、魚、一価不飽和脂肪/飽和脂肪比)の摂取量や比が中央値より多い場合1のスコアを、少ない場合0のスコアを、有害と考えられる食物群(魚肉以外の肉、乳製品)の摂取量が中央値より少ない場合1のスコアを、多い場合0のスコアを与えました。アルコールにつきましては、スコア1が、男性の場合1日摂取量が10~50g(エタノールとして)の時、女性の場合1日摂取量が5~25g(エタノールとして)の時与えられました。このようにMDSの合計は0~9となります。MDSが0の人は地中海食をほとんど実行しない人で、9の人は地中海食を忠実に実行する人です。(MDSについては詳しくは文献24を参照ください)。
MDSの各スコア群とテロメアの長さやテロメラーゼ活性との関係を調べてみますと、高スコア群のテロメアの長さやテロメラーゼ活性は(統計的に)有意に低スコア群や中スコア群よりも高値でした。テロメアは加齢によって短縮しますが、地中海食はこの短縮をどれくらい抑制できるのでしょうか。MDS低スコア群、中スコア群、高スコア群の1年間のテロメアの短縮数は、それぞれ72b、57b、51bでした。つまり、地中海食をほとんど実行しない人と地中海食を忠実に実行する人とでは、1年間にテロメアの長さが21b違ってくるということになります。10年間では210bになるとしますと、地中海食をよく食べる人はそうでない人に比べ、10年経った時生物学的に3.6年(平均の年間テロメア短縮数58で割った時)若いということになります。(また別の計算では、両者の最初のテロメア長が各10000bだったとして、これが5000bまで短くなると、細胞は分裂を停止し老化し死滅(アポトーシス)するとしますと、地中海食をほとんど実行しない人では69年で老化してやがて死んでしまいますが、地中海食を忠実に実行する人では老化するまでには98年かかるということになります。実に29年もの差ができてしまうことになります。個体レベルで、実際にここまで差が出るかどうかはわかりませんが、疫学的研究は地中海食がより長い寿命と健康寿命をもたらすことを示しています)。また、テロメラーゼは地中海食をよく食べる人ではより活性化されますが、MDS低スコア群に比べ高スコア群ではテロメラーゼ活性は約20%活性化されていました。
では、地中海食の何がテロメア長やテロメラーゼ活性に影響しているのでしょうか。MDS高スコア群の人たちの炎症性成分や活性酸素由来成分の血中濃度は、低スコア群に比べ低値を示しました。テロメアの長さやテロメラーゼ活性は、炎症スコアや活性酸素由来成分と負の相関関係がありました。炎症スコアは活性酸素由来成分と正の相関関係にありました。このことは、炎症反応が活性酸素の生成を高め、テロメアやテロメラーゼを障害し、テロメアの短縮やテロメラーゼ活性の低下を引き起こしているものと考えられました。一方、地中海食は炎症を抑え、活性酸素の生成を抑制することで、テロメアの短縮やテロメラーゼ活性の低下を抑制するものと考えられました。
次に、MDSスコアと健康度がどう相関するかについて見てみますと、健康な高齢者(高血圧、心筋梗塞、血管病、認知症、脳卒中、心不全を持たない人)の比率はMDSスコアが大きくなるほど高くなり、低スコア群に比べ高スコア群で1.6倍でした(健康な人の割合は低スコア群で34.3%、高スコア群で54.4%)。また、健康な高齢者のテロメアは、不健康な高齢者(上記の病気の二つ以上を併発)より長く(220bの差)、テロメラーゼ活性も健康な高齢者のほうがより高活性でした。
以上をまとめてみますと、地中海食、すなわち、野菜、マメ科植物、果実、穀物、魚、オリーブオイル(一価不飽和脂肪酸を豊富に含みます)を積極的に摂取し、魚肉以外の肉や乳製品の摂取をできるだけ控え、アルコールはほどほど(男性では1日にワインにして約90ml~450ml、女性では1日にワインにして約45~225mlが適正量です。但し、これはイタリアの白人の場合です。日本人の場合再検討する必要があるかもしれません(文献25)。)にした食事は、脂質代謝、血管拡張性、糖質代謝の異常など心血管病のリスクを低下させ、心血管病やがんによる死亡率を低下させ、より長い寿命と健康寿命をもたらします。この地中海食の健康効果は、主にその抗炎症効果および抗酸化活性に由来するものと考えられます。この抗炎症活性と抗酸化活性がテロメアを長くし、テロメラーゼ活性を高めたものと考えられます。一方、テロメラーゼはテロメアを長くします。つまり、地中海食は、その抗炎症活性と抗酸化活性によって、直接テロメアの障害を抑制して、テロメア長を長く維持し、また、その抗炎症活性と抗酸化活性によって(地中海食に含まれる栄養成分によって直接テロメラーゼが活性化される可能性もありますが)テロメラーゼ活性を高めることで間接的にテロメアを長くするものと考えられました。この長く維持されたテロメアによって、地中海食をよく食べる人に見られる、種々の健康効果と健康寿命の延長と長寿がもたらされたものと考えられます。
c)体内成分とテロメラーゼとの関係
◎ビタミンDとテロメラーゼの関係
ビタミンDは、腸管でのカルシウムの吸収を促進し、骨の形成を助けるビタミンとして知られていますが、そのほかに様々な作用を持っています。例えば、筋肉、炎症、免疫系、心血管系、脳神経系などへの作用が報告されています。ビタミンDはその作用機構と機能の多様性からホルモンに分類されることもあります。ビタミンDの欠乏は、種々の老化性疾患、例えば、骨粗鬆症、筋力低下、高血圧、2型糖尿病、心血管病、死亡率と関係があります。また、ビタミンDの体内濃度の低下は、種々の自己免疫疾患(多発性硬化症、関節リウマチ、1型糖尿病など)のリスク増大と関係がありました。一方、ビタミンDの摂取は、骨粗鬆症や筋力低下を改善し、血管の硬さや内皮反応性(動脈硬化と関係)を改善し、免疫関連疾患(1型糖尿病、多発性硬化症、関節リウマチ)の発症を抑制し重症度を減弱しました。ビタミンDの体内濃度と炎症マーカー(CRP)の間に逆の相関がみられ、ビタミンDは炎症反応を抑制すると考えられました。ビタミンDは脳神経系にも影響を与えます。ビタミンDの欠乏は認知機能の低下を引き起こし、認知症やアルツハイマー病のリスクを増大させました(ビタミンDが欠乏した人たちは、ビタミンDが欠乏していない人たちに比べ、認知症やアルツハイマー病発症のリスクが2倍以上増加しました)(文献26)。一方、ビタミンDの摂取は、老化による学習能力や記憶力の低下を改善しました。高齢者においてはビタミンDの体内濃度は低下しますので、これらの疾患のリスクはより増大するものと考えられます。そのため、特に高齢者ではサプリメントなどによりビタミンD(特に日光による活性化が必要でないビタミンD3)の積極的な摂取がすすめられます〔しかし、摂りすぎは過剰症(高カルシウム血症、腎障害など)を引き起こしますのでご注意ください。成人のビタミンDの1日の摂取量目安は5.5μgです。上限量は50μg/日です。海外品には大量のビタミンDが含まれているものがありますのでご注意ください〕。これらのビタミンDの作用にはテロメアやテロメラーゼが関与している可能性が考えられました。
2160人の女性(平均年齢49.4歳、英国)について、ビタミンD(25-ヒドロキシビタミンD)体内濃度と白血球テロメア長との関係が検討されました(文献27)。加齢によって白血球のテロメアは短縮しました。年間のテロメアの短縮数は21.5bpでした。25-ヒドロキシビタミンD濃度とテロメア長との間には正の相関がみられました。炎症マーカー(CRP)の濃度とテロメア長および25-ヒドロキシビタミンDの濃度との間には負の関係が見られました。被験者たちを25-ヒドロキシビタミンDの濃度に応じて3つに分類したところ、濃度が高いほどテロメア長は長くなりました。濃度が最も低い人たちのテロメア長と濃度が最も高い人たちのテロメア長の差は107.1bpでした。つまり、25-ヒドロキシビタミンD濃度が最も高い人たちは最も低い人たちに比べ生物学的に5年若いということになります(5年長生きする可能性があります)。被験者の約1/3(700人)がビタミンDのサプリメントを摂取していたために、ビタミンD摂取とテロメア長との関係が調べられました。ビタミンDを摂取している人たちは摂取していない人たちに比べより長いテロメア長を有していました。その差は110bpでした。このように、ビタミンDの濃度が高い人たちは低い人たちに比べより長い白血球のテロメア長を有していました。また、ビタミンDのサプリメントからの摂取によってもテロメア長は長く維持されることが明らかにされました。ビタミンDのこの作用は、炎症を抑制することで活性酸素の生成を抑え、それによるテロメアの障害を抑制し、それによってテロメア長が長く維持されたものと考えられました。ビタミンDによるテロメア長の維持によって生物学的老化が5年ほど抑制されると考えられました。
ビタミンDによるテロメア長の維持にテロメラーゼが関係しているかが検討されました(文献28)。肥満したアフリカ系アメリカ人は通常ビタミンDが不足していますので、その人たちを被験者としました。試験はランダム化二重盲検プラセボ対照臨床試験で行われました。被験者はビタミンD〔~2,000IU(~50μg)/日〕を摂取させたグループ(19人)とプラセボ(偽薬)群(18人)にランダムに分けられました。試験は16週間行われました。ビタミンDを摂取させたグループでは、摂取前に比べテロメラーゼ活性(PBMC)は19.2%増加していました。プラセボグループのテロメラーゼ活性(PBMC)は試験前に比べ変化はありませんでした。ビタミンDの血中濃度増加の程度とテロメラーゼ活性の増加の程度との間には有意な相関がありました。上記しましたように、ビタミンDはテロメア長を長く維持しますが、その働きの少なくとも一部はビタミンDのテロメラーゼ活性増加作用が関与しているものと考えられました。
◎女性ホルモンとテロメラーゼの関係
女性は男性に比べ長生きです。日本人の平均寿命は女性が86.6歳で、男性は80.2歳です(2013年厚生労働省調査)。また、100歳以上の高齢者数は58,820人(平成26年。厚生労働省調査)で、そのうち女性の占める割合は87.1%です。寿命における性差はテロメアに関係があると考えられています。生まれたばかりの頃はテロメアの長さに性差はありません。しかし、その後、男性のテロメア長は女性に比べ早く短くなります。短いテロメアは老化や老化病(心血管病、認知症、糖尿病、肝硬変、潰瘍性大腸炎、腎不全など)と関係があるといわれていますが、実際、これらの疾患の中には男性が罹りやすいものが多いようです(心血管病、脳血管性痴呆、糖尿病、肝硬変など)。また、男性の短いテロメアが寿命の短さと関係があるといわれています(文献29)。実際、ある報告によると、年齢とは関係なく、女性のほうが男性より長いテロメアを持っていました(被験者はイタリアの平均年齢77.9歳の男女)。テロメア長の差から計算した時、女性は男性より生物学的に5.7年若いということになりました。なお、この差は平均寿命の差〔約5年。男性の平均寿命80歳、女性の平均寿命85歳(2012年)〕(文献22)とほぼ一致しました。
では、テロメア長における男女の差は何が原因なのでしょうか。その大きな要因の一つが女性ホルモンです。テロメアは活性酸素によって傷つけられやすく、それによってテロメアは短くなります。そのため、テロメアの長さを維持するためには活性酸素の害からテロメアを守ってやる必要があります。エストロゲン(女性ホルモン)は活性酸素の生成を抑えます。一方、テストステロン(男性ホルモン)はそのような作用を持っていません。この差が男女におけるテロメア長の差の原因の一つになっている可能性があります。
テロメア長の維持にはテロメラーゼの働きが極めて重要です。テロメラーゼは短くなったテロメアも長くすることができます。そのためテロメラーゼの活性化はテロメアを長く保ち、老化や老化病を防ぎ寿命の延長ももたらします。エストロゲンは直接あるいは間接的にテロメラーゼを活性化します(文献29)。なお、エストロゲンによるテロメラーゼの活性化には、eNOS(血管内皮型一酸化窒素合成酵素)の活性化によるNO(一酸化窒素)の生成が必要なことが報告されています(文献30)。
このように、生殖期にある女性ではエストロゲンによる酸化ストレスの軽減作用やテロメラーゼ活性化作用によりテロメアが長く維持されるため、女性は男性に比べ老化や老化病に罹りにくいですが、閉経後はエストロゲンの急激な低下により、その保護作用がなくなり、その後は男性と同様に老化や老化病が進みますが(文献31)、生殖期での貯金があるため(女性では男性に比べ長いテロメアを持っているため)、結果的に、男性に比べて女性では老化や老化病発症の遅延や長寿命がもたらされるものと考えられます。
内因性のエストロゲンとテロメアの関係が検討されました(文献32)。女性においては、生殖期年数、つまり、内因性のエストロゲンによる曝露年数(初潮から閉経までの期間として計算)の長さと老化や老化病(心血管病、認知症など)に対するリスクの低下が関係すると考えられています。そこで、閉経後の女性を対象に、内因性のエストロゲンの曝露年数とテロメア長やテロメラーゼ活性との関係が検討されました。53人の閉経後の女性(全員がホルモン療法を受けていました)が被験者となりました。内因性のエストロゲンの曝露年数の長さとテロメアの長さ、および低下したテロメラーゼ活性との間に有意な(統計的に)関係がありました。つまり、生殖期年数が長いほどテロメアも長くなり、逆にテロメラーゼ活性は低下するということを示しています。一方、閉経後のホルモン療法の長さとテロメア長やテロメラーゼ活性との関係は見出されませんでした。このことから内因性のエストロゲンは女性において細胞老化の抑制と関係があると考えられました。本研究では、内因性のエストロゲンの曝露年数とテロメラーゼ活性との間には負の関係が見られましたが、これは前述した、エストロゲンはテロメラーゼを活性化するという以前の報告(試験管内)と異なっているように思われます。しかし、本研究では、テロメラーゼ活性は閉経後数年以上経ってから測定されました。テロメラーゼ活性は、当然のことながら、エストロゲンが存在しているときは活性化されていますが、エストロゲンが存在しなくなれば低下します(文献33)。そのことから、閉経後数年以上経ったときに測定されたテロメラーゼ活性は、内因性のエストロゲンが低下した時の状態を示しているために、当然低下しているものと考えられます。
エストロゲンを内因性ではなく、外因性に投与した時に、投与しない場合と比較してテロメアにどういう効果があるか検討されました(文献34)。被験者は、55歳から69歳までの閉経後の女性で、5年以上ホルモン療法を受けているグループ(65人)と、閉経後ホルモン療法を受けていないグループ(65人)のテロメアの長さが比較検討されました。その結果、ホルモン療法を受けているグループは、ホルモン療法を受けていないグループに比べ、より長いテロメア長を持っていました。ホルモン療法を受けているグループは、ホルモン療法を受けていないグループに比べ、BMI、空腹時血糖値が有意に(統計的に)に低く、HDLコレステロールが有意に高く、運動頻度やビタミン摂取率が有意に高く、これらがテロメア長に影響している可能性が考えられましたので、これらの因子を調整して統計解析がなされた結果、テロメア長と関係があるのはホルモン療法のみでした。
以上のことから、女性ホルモン(エストロゲン)は、その抗酸化作用とテロメラーゼ活性化作用によりテロメア長を長く維持します。その結果、女性は男性に比べ老化や老化病にかかりにくく寿命が長いものと考えられました。しかし、女性ホルモン(エストロゲン)は、当然のことながら男性には投与することはできないので、男性は女性ホルモンの抗老化作用、老化病抑制作用、長寿命効果を享受することはできません。また、女性でも閉経後は女性ホルモンは激減するため、その効果を享受することはできません。その場合はホルモン療法(HRT)あるいはエストロゲン療法(ERT)がありますが、心血管系、乳がん、静脈血栓症など種々の副作用の問題からその使用法や使用期間などに制限があります(文献35)。ではそのせっかくの良い効果は男性や閉経後女性は享受できないのでしょうか。それに対する答えはNO(一酸化窒素)にあります。エストロゲンのテロメラーゼ活性化作用(文献30)、血管(文献36)や骨(文献37)に対する作用、(細胞)老化抑制作用(文献30b)など、その健康効果の多くは一酸化窒素を介することが知られています。そのために、NOをアルギニンから生成する酵素、一酸化窒素合成酵素(NOS、特にeNOS)を活性化する成分(アルギニンなど)を使うことによってエストロゲンと同等以上の(NOの直接効果もありますので)抗老化、老化病抑制効果、寿命延長効果などが期待できます。また、アルギニンはアミノ酸ですので安全性が高く安心して摂取することができます。もちろん性ホルモン作用はありません。
◎アルギニン(NO)とテロメラーゼの関係
テロメラーゼはNO(一酸化窒素)によって主にコントロールされていると考えられています(文献38、39)。細胞の老化やテロメア長、テロメラーゼ活性がNOによってどういう影響があるかが検討されました(文献40)。血管内皮細胞(ヒト臍帯静脈由来、HUVEC)は、細胞分裂させるたびに老化していき、それと共にテロメア長が短くなっていきました。また、テロメラーゼ活性は細胞分裂と共に低下しました。テロメラーゼ活性の低下は細胞老化の開始に先行していました。つまり、細胞は分裂するたびに少しづつテロメラーゼ活性が低下していき、それと共にテロメア長が短くなり、細胞老化が進むと考えられました。この細胞老化に対するNOの効果が検討されました。血管内皮細胞(HUVEC)はNO存在下で培養すると、細胞の老化は最大約50%抑制されました。また、老化の抑制と共にテロメラーゼ活性の低下およびテロメア長の短縮も抑制されました。一方、血管内皮細胞(HUVEC)をNOS(一酸化窒素合成酵素)阻害剤〔アルギニンからNOを合成する酵素(NOS)の働きを阻害してNOが合成されないようにする化合物〕と共に培養すると、テロメラーゼ活性は強力に抑制され、老化は促進されました。それに対し、血管内皮細胞(HUVEC)をNOと共に培養すると、テロメラーゼ活性は約3倍増加しました。すなわち、NOはテロメラーゼ活性をコントロールしているものと考えられました。なお、血管内皮細胞の老化は動脈硬化や老化の促進因子になると考えられています。
eNOS(血管内皮型一酸化窒素合成酵素)の活性化(NO生成の増加)がテロメラーゼ活性にどういう影響を示すかが検討されました(文献41)。HEK293細胞(ヒト胎児腎細胞由来)またはHUVEC(ヒト臍帯静脈由来血管内皮細胞)にeNOSを遺伝子導入しますと、NOの生成は1.82倍に増加し、テロメラーゼ活性は2.24倍に増加しました。一方、細胞の老化はeNOSの導入によって抑制されました。糖尿病においては、動脈硬化のリスクが大幅に増加し、動脈硬化性疾患(心筋梗塞、脳梗塞、閉塞性動脈硬化症など)に罹りやすくなることが知られていますが、その原因は、高血糖によって血管内皮細胞が障害を受け、eNOSの活性が低下するためと考えられています(NOは抗動脈硬化因子です)。実際、HUVECを高濃度のグルコースに曝しますと、高濃度になるほどeNOSの発現レベルが減少しました。また、NOの生成はグルコースの濃度の増加と共に減少し、逆に活性酸素の生成量は増加しました。一方、高濃度のグルコースによって低下したNOの生成量は、アルギニンによって回復する傾向にありました。次いでアルギニンにシトルリンを加えると回復の程度は増加しました。さらにアルギニンとシトルリンに加え抗酸化剤(ビタミンC+ビタミンE)を同時に加えますと、NOの生成量はより増加し、ほぼ正常レベルまで回復しました。このことは、アルギニンとシトルリンと抗酸化剤(ビタミンC+ビタミンE)の間には相加効果あるいは相乗効果があるということを示しています。細胞老化に対する高濃度グルコースの影響を見てみますと、細胞(HUVEC)は、高濃度のグルコースによって老化が促進されました。また、テロメラーゼ活性は低下しました。一方、高濃度のグルコースによる細胞の老化は、アルギニンによって抑制される傾向にありました。次いでアルギニンに加えシトルリンを加えますと老化抑制の程度は増加しました。さらにアルギニンとシトルリンに加え抗酸化剤(ビタミンC+ビタミンE)を同時に加えますと、老化抑制の程度はより増加し、明らかに(統計的に有意に)老化は抑制されました。次に、細胞にeNOSを導入しますと高濃度のグルコースによる細胞の老化は抑制される傾向にありましたが、eNOSの活性化剤であるアルギニンを加えると老化抑制の程度はより増加しました。これにシトルリンを加えますと老化抑制の程度はさらに増加しました。次いで、これに抗酸化剤(ビタミンC+ビタミンE)を加えますと老化はさらに抑制され、統計的に有意に抑制されました。このように、細胞の老化に対しても、シトルリンと抗酸化剤はアルギニンの働きを相加的または相乗的に増強しました。
では、どうしてアルギニンとシトルリンと抗酸化剤を同時に加えると、アルギニンの働きが相加的または相乗的に増強されるのでしょうか。先ずシトルリンですが、二つの可能性があります。一つは、シトルリンは内皮細胞を含む種々の細胞においてアルギニンに変換されることが知られています(文献42)。このことから、シトルリンを加えることでアルギニンの濃度が高くなったためと考えられます。もう一つの可能性はアルギナーゼが関係しています。アルギナーゼはアルギニンをオルニチンと尿素に分解する酵素ですが、内皮細胞などに発現しています(文献43、44)。アルギナーゼは種々の因子によってその発現が促進されますが、内皮細胞においては、糖尿病(高血糖)、活性酸素、高血圧、酸化LDL(動脈硬化の原因物質の一つ)などによってアルギナーゼの発現が促進されます。このような場合に、アルギニンはアルギナーゼによって分解されるため、アルギニンの濃度は減少しNOの生成は低下します。一方、シトルリンはアルギナーゼを阻害し、アルギニンの分解を抑制します(文献42、45)。このように、シトルリンは、これら二つの作用の一つまたは両作用によって細胞内のアルギニン濃度を高く保つと考えられます。
次に抗酸化剤について述べます。eNOSはアルギニンからNOを合成する酵素ですが、活性酸素によって容易にその活性が低下します。一方、抗酸化剤は活性酸素を消去し、eNOSの活性低下を抑制します。このようなメカニズムによって、アルギニンと抗酸化剤を同時に加えることによって、アルギニン単独よりもNOの生成が増強されると考えられます(文献46、47、48)。また、抗酸化剤は、活性酸素を消去することで、活性酸素によるテロメラーゼ活性の減少やテロメアの短縮を抑制します。
以上まとめますと、アルギニンは、eNOSの働きでNOに変換され、これが細胞のテロメラーゼを活性化し、テロメアを長く保持することで老化を抑制したものと考えられました。また、アルギニンの働きは、シトルリンや抗酸化剤によって相加的または相乗的に増強されました。
1-1-3)アルギニン(NO)および他成分のテロメラーゼおよびテロメアに対する作用と老化および老化病抑制作用(まとめ)
次の図は、アルギニン(NO)のテロメラーゼ活性化作用と老化や老化病抑制作用との関係、また、シトルリンのアルギニンへの変換やアルギナーゼ抑制作用、抗酸化剤のeNOS活性化作用や老化および老化病抑制作用との関係を示しました。これらの作用により、アルギニン(NO)や抗酸化剤は老化や老化病を抑制することが期待できます。さらに、アルギニン(NO)とシトルリンと抗酸化剤を同時に摂取することでさらに強力に老化や老化病を抑制することが期待できます。寿命を延ばし、老化や老化病を抑制するといわれている多くの生体成分や天然成分、あるいはライフスタイルがテロメラーゼ活性化作用や保護作用、テロメア保護作用を示すことが報告されていますが、その作用にはそれらの抗酸化作用やNOを介する作用が働いているものと考えられます。
図.アルギニン(NO)および他成分のテロメラーゼおよびテロメアに対する作用と老化および老化病抑制作用との関係
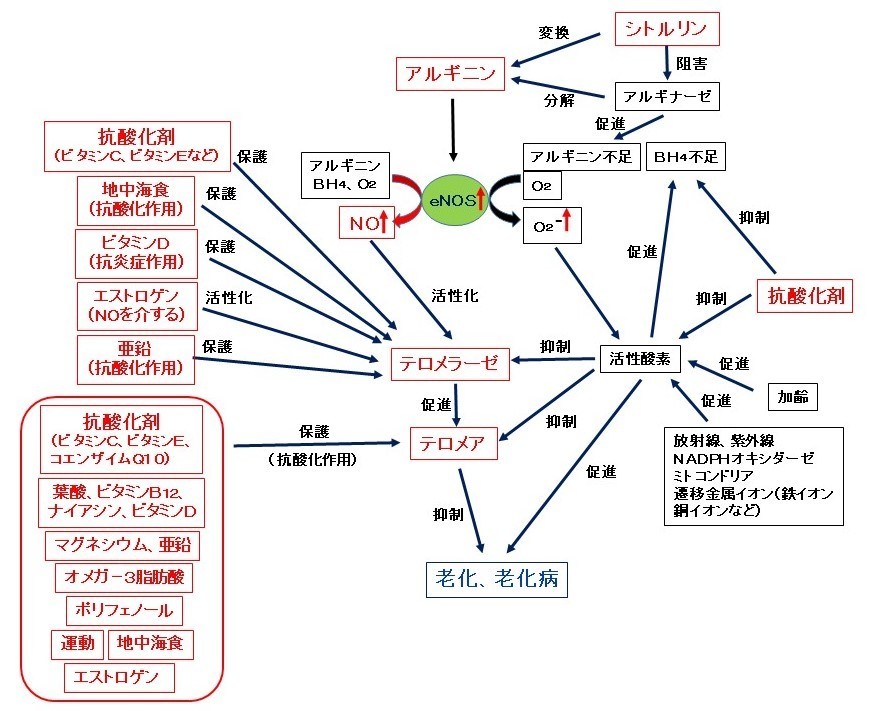
【図の説明】
アルギニンからeNOS(血管内皮型一酸化窒素合成酵素)の働きで生成したNO(一酸化窒素)は、テロメラーゼを活性化しテロメアを長くします。テロメアを長くすることで老化や老化病が抑制され、寿命が延長することが期待できます。シトルリンは体内でアルギニンに変換されアルギニンの供給源となります。また、シトルリンは、アルギニンを分解しアルギニン不足をもたらすアルギナーゼの働きを阻害します。一方、加齢、放射線、紫外線、NADPHオキシダーゼ、ミトコンドリア、遷移金属(鉄イオン、銅イオンなど)などにより生成した活性酸素は、eNOSの正常な働きに必要なBH4(テトラヒドロバイオプテリン)を酸化し減少させます。BH4やアルギニンの不足は、eNOSの正常な働き(アルギニンからNOを生成する)を阻害し、NOを生成する代わりに活性酸素(スーパーオキシド、O2-)を生成します(eNOSアンカップリング)。そのため、抗酸化剤(ビタミンCなど)はBH4の減少を防ぎ、eNOSを活性化し、NOの生成を促進します。つまり、アルギニンと抗酸化剤は相乗的にeNOSを活性化しNOの生成を促進します。また、活性酸素はテロメラーゼやテロメアを抑制し、老化や老化病を促進しますが、抗酸化剤は活性酸素の害から体を守り、老化や老化病を抑制します。このように、アルギニン単独でも老化や老化病を強力に抑制しますが、シトルリンや抗酸化剤を同時に摂取することでより強力に老化や老化病を抑制し、寿命(勿論健康寿命も)を延長するものと考えられます。すなわち、アルギニンは、NOのテロメラーゼ活性化作用によってテロメア長を維持し、老化や老化病(肥満、メタボリックシンドローム、高血圧、糖尿病、動脈硬化、心血管病、骨粗鬆症、認知症、がんなど)を抑制し、寿命を延長することが期待できます。
一方、種々の生体成分や天然成分やライフスタイルがテロメラーゼを活性化(保護)したり(抗酸化剤、地中海食、ビタミンD,エストロゲン、亜鉛など)、テロメアを保護してその短縮を抑制したり〔抗酸化剤、ビタミン類(葉酸、ビタミンB12、ナイアシン、ビタミンDなど)、ミネラル(マグネシウム、亜鉛など)、オメガ―3脂肪酸、ポリフェノール、運動、地中海食、エストロゲンなど〕することが報告されていますが、それらの働きはそれら成分やライフスタイルによる抗酸化作用やNOを介する作用が主に関係しているものと考えられます。
(文献、資料)
1)「老化・寿命のサイエンス」(実験医学増刊、2013)。
2)「ハーパー・生化学」(原書29版)(丸善出版、平成25年)。
3)「アンチエイジング医学の基礎と臨床」(日本抗加齢医学会。2011年)。
4)「健康寿命を伸ばす!アンチエイジングへの取り組み」(東洋出版、2014年)。
5)「細胞増殖の仕組み-細胞周期、癌遺伝子、細胞老化-」(薬学雑誌、126、1087(2006))。
6)"Association between telomere length in blood and mortality in people aged 60 years or older" Lancet, 361, 393 (2003).
7)"Association Between Higher Plasma Lutein, Zeaxanthin, and Vitamin C Concentrations and Longer Telomere Length: Results of the Austrian Stroke Prevention Study" J Am Geriatr Soc, 62, 222 (2014).
8)"Multivitamin use and telomere length in women" Am J Clin Nutr, 89, 1857 (2009).
9)"Diet, nutrition and telomere length" Journal of Nutritional Biochemistry, 22, 895 (2011).
10)"Mortality in randomized trials of antioxidant supplements for primary and secondary prevention: systematic review and meta-analysisi" JAMA, 297, 842 (2007).
11)国立健康・栄養研究所の「健康食品」の安全性・有効性情報の『ビタミンA(レチノール)』の項を参照ください。
12)国立健康・栄養研究所の「健康食品」の安全性・有効性情報の『カロテン』の項を参照ください。
13)"Coenzyme Q10 prevents accelerated cardiac aging in a rat model of poor maternal nutrition and accelerated postnatal growth" Molecular Metabolism, 2, 480 (2013).
14)"The association Between Physical Activity in Leisure Time and Leukocyte Telomere Length" Arch Intern. Med, 168, 154 (2008).
15)「活性酸素の本当の姿」(有限会社ナップ、2014年)。
16)"Effect of Different Intensities of Exercise on Endothelium-Dependent Vasodilation in Humans - Role of Endothelium-Dependent Nitric Oxide and Oxidative Stress" Circulation, 108, 530 (2003).
17)"Antioxidants prevent health-promoting effects of physical exercise in humans" Prc Natl Acad Sci USA, 106, 8665 (2009).
18)"Meta-Analysis: High-Dosage Vitamin E Supplementation May Increase All-Cause Mortality" Ann Intern Med, 142, 37 (2005).
19)"Telomerase reactivation reverses tissue degeneration in aged telomerase deficient mice" Nature, 469, 102 (2011).
20)"Mediterranean Diet, Lifestyle Factors, and 10-Year Mortality in Elderly European Men and Women" JAMA, 292, 1433 (2004).
21)"Mediterranean Diet, Telomere Maintenance and Health Status among Elderly" PLoS One, 8, e62781 (2013).
22)WHO資料。総務省統計局。
23)"Study Finds DNA Length Can Predict Life Expectancy" (Intermountain Medical Center, USA, 2013)など。
24)"Adherence to a Mediterranean Diet and Survival in a Greek Population" N Engl J Med, 348, 2599 (2003).
25)”健康日本21(アルコール)”(厚生労働省)。
26)"Vitamin D and the risk of dementia and Alzheimer disease" Neurology, 83, 920 (2014).
27)"Higher serum vitamin D concentrations are associated with longer leukocyte telomere length in women" Am J Clin Nutr, 86, 1420 (2007).
28)"Increased Telomerase Activity and Vitamin D Supplementation in Overweight African Americans" Int J Obes (Lond), 36, 805 (2012).
29)"Sex differences in telomeres and lifespan" Aging Cell, 10, 913 (2011).
30a)"Estrogen Receptor-α and Endothelial Nitric Oxide Synthase Nuclear Complex Regulates Transcription of Human Telomerase" Circ Res, 103, 34 (2008). 30b)"Endothelial cellular senescence is inhibited by nitric oxide: Implications in atherosclerosis associated with menopause and diabetes" Prc Natl Acad Sci USA, 103, 17018 (2006).
31)「エストロゲンと血管」 日本生殖内分泌学会雑誌、18、11(2013)。「閉経後脂質異常症」 日産婦誌、61、N-520(2009)など。
32)"Greater endogeneous estrogen exposure is associated with the telomere maintenance in postmenopausal women at risk for cognitive decline" Brain Res, 16, 1379 (2011).
33)"Estrogen deficiency reversibly induces telomere shortening in mouse granulosa cells and ovarian aging in vivo" Protein Cell, 2, 333 (2011).
34)"Effect of Long-Term Hormone Therapy on Telomere Length in Postmenopausal Women" Yonsei Medical Journal, 46, 471 (2005).
35)「ホルモン補充療法ガイドライン2012年度版解説」 日産婦誌、65、N-49(2013)。「HRTは何時まで続けることが可能か」 日産婦誌、63、N-155(2011)。
36)"Mechanism of Cerebrovascular Protection: Estrogen, Inflammation and Mitochondria" Acta Physiol (Oxf), 203, 149 (2011).
37)"Nitric oxide as a mediator of estrogen effects in osteocytes" Vitam Horm, 96, 247 (2014).
38)"The telomerase tale in vascular aging: regulation by estrogens and nitric oxide signaling" J Appl Physiol, 106,333 (2009).
39)"Mechansms involved in the aging-induced vascular dysfunction" Frontiers in Physiology, 3, 1 (2012).
40)"Nitric Oxide Activates Telomerase and Delays Endothelial Cell Senescence" Circ Res, 87, 540 (2000).
41)"Endothelial cellular senescence is inhibited by nitric oxide: Implications in atherosclerosis associated with menopause and diabetes" Prc Natl Acad Sci USA, 103, 17018 (2006).
42)"Therapeutic Use of Citrulline in Cardiovascular Disease", Cardiovascular Drug Reviews, 24, 275 (2006).
43)"Arginase as a potential target in the treatment of cardiovascular disease: reversal of arginine steal?", Cardiovascular Research, 98, 334 (2013).
44)"Arginases and Arginine Deficiency Syndromes", Curr Opin Clin Nutr Metab Care, 15, 64 (2012).
45)"Diabetes-induced Coronary Vascular Dysfunction Involves Increased Arginase Activity", Circ Res, 102, 95 (2008).
46)"Effects of vitamin C on intracoronary L-arginine dependent coronary vasodilatation in patients with stable angina", Heart, 91, 1319 (2004).
47)"Beneficial effects of antioxidants and L-arginine on oxidation-sensitive gene expression and endothelial NO synthase activity at sites of disturbed shear stress", Proc Natl Acad Sci USA, 100, 1420 (2003).
48)"Tetrahydrobiopterin, L-Arginine and Vitamin C Act Synergistically to Decrease Oxidant Stress and Increase Nitric Oxide That Increases Blood Flow Recovery after Hindlimb Ischemia in the Rat", Mol Med, 18, 1221 (2012).
【その他のテロメア長維持物質(特にTA-65について)】
すでに述べましたように(1-1)テロメア説)、遺伝子工学的な操作によって、動物のテロメラーゼを活性化し、テロメアを長くすることは、若返りを可能とし、寿命の延長も可能にすることが示されています。一方、健康に良いとされる、抗酸化成分、微量栄養素(ビタミン、ミネラルなど)、栄養素、運動、地中海食、ビタミンDなどが、主にそれらの抗酸化作用によって、テロメアを長く維持することが示されています(図)。また、食事(地中海食)、ビタミンD、ホルモン(女性ホルモン)、アルギニン(NO)などがテロメラーゼを活性化し、テロメアを長く維持します(図)。このような、昔から普遍的に、そして常時体内に摂取している成分、体内成分、また好ましいライフスタイルなどは、それを一生継続するのに安全性面で特に問題はないと考えられますので、これらは特にテロメア長を維持して、長寿(健康長寿)、老化および老化病抑制、あるいは若返りを達成するために、日常において是非とも取り入れて頂きたい成分や方法です(ただし、女性ホルモンについては注意が必要です。それについては「◎女性ホルモンとテロメラーゼの関係」を参照ください)。これらの成分や方法を積極的に、うまく取り入れることによって、120歳あるいはそれ以上の長寿も夢ではないかもしれません。あるいは、100歳になっても何ら病気もせずに、若者のように溌剌、生き生きとした人生を送れるかもしれません。
一方、上記のような成分や方法以外に、テロメア維持物質やテロメラーゼ活性化物質を探索する研究がいろいろ行われています。現在、テロメラーゼを活性化し、テロメアを長くするとされている物質として、良く知られているものの一つとしてTA-65があります。以下それについて述べたいと思います。
TA-65は、キバナオウギ(Astragalus membranaceus)の根から精製された成分です。キバナオウギは、古来中国や日本で生薬として用いられてきましたが、TA-65はその単離精製成分ですので、化合物としての長期安全性は確立されていません。そのため長期使用には十分注意する必要があります。
TA-65は、マウスの胚性繊維芽細胞(テロメラーゼ活性を有している)のテロメラーゼを約2.5倍活性化しました(文献1)。また、TA-65は、短いテロメア(8kbp未満)の比率を下げました〔すなわち短いテロメア(8kbp未満)の長さを伸ばしました〕。一方、テロメラーゼ活性を有しない細胞(マウス胚性繊維芽細胞)においては、TA-65はテロメアの長さに影響しませんでした。このことは、TA-65のテロメア伸長作用はテロメラーゼの活性化を介していることを示しています。なお、テロメラーゼ活性を有していない細胞の短いテロメア(8kbp未満)の比率は、テロメラーゼ活性を有している細胞の2.4倍でした。テロメアの平均長についても、TA-65はそれを伸ばすことが示されました。TA-65をマウスに経口投与した時のテロメラーゼやテロメアへの影響が検討されました。その結果、TA-65は肝臓においてテロメラーゼ(mTERTmRNAレベル)を活性化しましたが、他の組織においてはほとんど活性化は見られませんでした。テロメアに関しましては、TA-65は末梢血白血球の平均テロメア長に影響しませんでしたが、短いテロメア(2kb未満、3kb未満、4kb未満)の比率が減少しました。これらのことから、試験管内においても、動物試験においても、TA-65はテロメラーゼを活性化して、短いテロメアを優先的に伸長してその割合を下げることが示されました。しかし、平均テロメア長については試験管内ではそれを伸ばしましたが、動物試験ではそれに影響しませんでした。
次に、TA-65の健康への影響が検討されました。TA-65をマウスに4ヶ月間投与するとグルコースの取り込みが促進されました。一方、血中インスリンについては低下する傾向がみられました。これはTA-65によりインスリン抵抗性が改善されたものと考えられました。肝臓への作用が検討されました。TA-65は老化による肝臓への脂肪の蓄積を抑制する傾向を示し、肝保護作用を示すものと考えられました。老化によって皮膚が薄弱化します。TA-65は老化によって生じた皮下脂肪層と表皮層の厚さの低下を抑制しました。また、TA-65は傷の治りや毛の再生を促進しました。老化によって骨がもろくなりますが、TA-65は老化マウス(2年齢)の骨密度を増加させました。
TA-65の寿命への影響が調べられました。TA-65をマウス(1年齢、2年齢)に4ヶ月間投与した時、その後の生存率に影響はみられませんでした。つまり、TA-65はこの条件下では寿命延長に効果を示しませんでした。また、TA-65の投与によってマウスに腫瘍の発生が増加するということは見られませんでしたが、肝臓において腫瘍が増加するリスクが示されましたので、今後長期投与によって検討する必要があると考えられます。
TA-65は、人新生児角質細胞のテロメラーゼ活性を2~3倍高めました。また、TA-64は、人胎児繊維芽細胞や免疫系細胞のテロメラーゼも活性化しました(文献2)。一方、テロメア長に対しては、人にTA-65を1年間経口摂取した時、白血球のテロメアの長さを調べたところ、テロメアの平均長に対してはTA-65は特に変化を示しませんでしたが、4kbp未満の短いテロメアについてはその比率が減少していました(4kbp未満の長さのテロメアは、特に老化や病気の発現に重要と考えられています。そのため、4kbp未満のテロメアの比率や数が減少するということはそのリスクが低下すると考えられます)。免疫系に関しては、TA-65は、老化した細胞傷害性T細胞やNK細胞の比率を減少させました(免疫系が若返ったということを示しています)。TA-65の1年間の投与で特に副作用はみられなかったということです。
TA-65の1年間の予備的な試験(厳密なランダム化プラセボ対照比較試験ではありません)において、代謝関係や心血管系に対する効果が報告されています(文献3)。試験前に97~107人の被験者の代謝マーカーが測定されました(ベースラインデータ)。次いで、試験開始後12ヶ月間にわたって3~6ヶ月ごとに27~59人の被験者の代謝マーカーが測定されました。その結果、ベースラインからの1年間の変化は、空腹時血糖値は—3.72mg/dL、インスリン値は—1.32mIU/mL、トータルコレステロール値は—13.2mg/dL、LDL-C値は—11.8mg/dL、収縮期血圧は—17.3mmHg、拡張血圧は—4.2mmHg、ホモシステイン値(心血管系のリスク因子と考えられています)は—3.6μmole/Lでした。骨密度に関しては、脊椎骨において2.0%増加していました。
では、TA-65のテロメア伸長作用や健康効果、あるいは長期安全性について、すでに述べました抗酸化成分、微量栄養素(ビタミン、ミネラルなど)、栄養素、運動、地中海食、ビタミンD、アルギニン(NO)と比較してみます(女性ホルモンについては一般に使用するには問題がありますのでここでは省きます)。TA-65は、テロメラーゼを活性化してテロメアを伸ばすとされていますが、その作用は弱く、テロメアの平均長を長くすることはできません(テロメアの平均長が変化しない範囲で、極端に短いテロメアのみを伸ばします)。これはどういうことを意味しているのでしょうか。おそらく、TA-65は老化や酸化ストレスなどにより極端に短くなったテロメアを長くしますが、その作用は弱く平均長に影響するほどではなかったということになります。このことから、TA-65の寿命延長や老化や老化病抑制作用はそれほど強くないものと考えられます。実際、TA-65は、マウスの寿命を延長しませんでした。また、TA-65は、人を用いた試験で免疫系を若返らせたり、空腹時血糖値、インスリン値、コレステロール値、LDL-C値、血圧、ホモシステイン値を低下させ、骨密度も改善しましたが、これが実際、老化や老化病の抑制による死亡率の低下や寿命延長に結びつくかは不明です。また、長期使用による安全性も不明です(肝臓において腫瘍が増加するリスクがあります)。
一方、抗酸化成分、微量栄養素(ビタミン、ミネラルなど)、栄養素、運動、地中海食、ビタミンD、アルギニン(NO)などは、それらの多くが人類が地球上に出現して以来ずっと摂取して来たり実施してきたことですので、長期安全性は特に問題ないはずです。また、これらのテロメアに対する働きは強く、平均テロメア長を伸長しました。また、これらの多くは、寿命を延ばし、死亡率を低下させ、老化や老化病(肥満、高血圧、高脂血症、糖尿病、動脈硬化、アルツハイマー病、骨粗鬆症、がんなど)を抑制することは良く知られています。つまり、現時点では、寿命や老化や老化病に対する効果がはっきりせず、また、長期の安全性も確立されていないTA-65を、寿命延長や老化や老化病抑制のため使用する理由は見当たりません(今後臨床試験や長期安全性試験を積み重ねていくことによって、TA-65にもある程度の価値が見出される可能性はあるかもしれませんが)。
すなわち、すでに述べました抗酸化成分、微量栄養素(ビタミン、ミネラルなど)、栄養素、運動、地中海食、ビタミンD、アルギニン(NO)などをうまく組み合わせることによって、かなりの程度寿命延長や老化や老化病抑制が可能と考えられます。もちろん、これらの成分やライフスタイルの長期安全性は特に問題ないと考えられます(寿命延長や老化や老化病抑制には数十年以上~ほぼ一生の長期の使用が必要と考えられます。そのため、長期安全性は極めて重要です)。なお、女性ホルモンに関しましては5年程度の寿命延長と老化や老化病抑制が期待できますが、一般に使用するには安全性などの問題があります。女性ホルモンによるテロメラーゼ活性化作用にはNOが関係していますので、NO生成を促進するアルギニンによって同様な効果が期待できます。実際、アルギニンは寿命を延長し、老化や老化病を強力に抑制しました(「2.アルギニンの寿命延長、老化および老化病の予防・改善作用」を参照ください)。
(文献、資料)
1)"The telomerase activator TA-65 elongates short telomeres and increases health span of adult/old mice without increasing cancer incidence" Aging Cell, 10, 604 (2011).
2)"A Natural Product Telomerase Activator As Part of a Health Maintenance Program" Rejuvenation Res, 14, 45 (2011).
3)"A natural product telomerase activator as part of a health maitenance progaram: metabolic and cardiovascular response" Rejuvenation Res, 16, 386 (2013).
1-2)長寿遺伝子説
現在、多くの生物で共通して寿命を延長する唯一の方法はカロリー制限です。原生動物、ミジンコ、クモ、魚、マウス、ラットなど幅広い動物種で摂取カロリーを制限すると共通して寿命が1.4倍から1.9倍に延長することが明らかとなりました(文献1、2)。ラットの場合は60~70%カロリー制限を行うと寿命は1.4倍延長しました。サルや人でもその可能性が示唆されています。カロリー制限を受けているマウスやラットでは通常食のマウスやラットに比べ小さく痩せており、脂肪蓄積量も少ないことが示されています。また、主要な臓器が小さくなります。さらに、より活発に動き、見た目を若く保ち、老化や老化病が抑制されますが、低温に対する抵抗力が弱くなります。また、カロリー制限を始める時期や行っている期間が寿命延長の効果に影響を与えます。
しかし、カロリー制限を人に応用するには多くの問題点があります。実験動物は通常ほとんど無菌状態で飼育されており、人の生活条件とは異なります。また、カロリー制限は成長に影響するため、成長期にそれを行うのは好ましくありません。実際には目立った老化が始まる30代後半から40代くらいで始めるのが望ましいと考えられます。一方、動物実験で行われたようなかなり厳しいカロリー制限は現代人には到底実施し難いように思われ、また例え出来ても長続きしないと考えられます。これらのことから、一般の人が寿命を延長するほどのカロリー制限を半生でも続けられるとはとても思えません。ということで、カロリー制限と同様なメカニズムで寿命の延長ができ、手軽に、そして長期間の摂取にも問題のない安全性の高い物質の探索が進められ、いくつかの物質が候補に上げられてきました。
カロリー制限による寿命延長や老化抑制には様々な因子が関与していることが報告されていますが、その中で主要な因子としてサーチュインが知られています。サーチュインはサーチュイン遺伝子(長寿遺伝子とも呼ばれています)の活性化により合成されるタンパク質で、色々なメディアでも広く取り上げられるようになったため、一般の人々にも広く知られる存在になってきました(2)。そのため、サーチュインを活性化する物質が老化を抑制し長寿をもたらすのではないかと熱い期待が寄せられています。
サーチュインは様々な働きを示しますが、中でも重要なのはPGC-1αを活性化し、ミトコンドリアを活性化することです。サーチュイン(SIRT1)の働きを遺伝子導入法により高めたマウスでは、カロリー制限で見られるのと同様な現象が見られました。一方、遺伝子欠損法でSIRT1を欠損させたマウスではカロリー制限による運動機能改善や寿命延長が見られなくなりました。これらのことから、サーチュイン(SIRT1)は、カロリー制限による老化抑制や寿命延長などの効果をもたらす主要な因子と考えられました。
では、サーチュイン遺伝子(長寿遺伝子)を活性化し、ミトコンドリアを活性化することが、なぜ老化や老化病の抑制、あるいは寿命延長に結びつくのでしょうか。それについて少し詳しく述べたいと思います。
(文献、資料)
1)「アンチエイジング医学の基礎と臨床」(日本抗加齢医学会。2011年)。
2)「老化・寿命のサイエンス」(実験医学増刊、2013)。
1-2-1)ミトコンドリアとは
電気は私たちが生活していくうえでなくてはならないもので、もし電気が不足したり供給されなくなると私たちの生活は大変不自由になり、また都市機能そのものが破たんしてしまいます。
それと同様に私たちが生きていくためにはエネルギーが必要です。動いているとき、運動しているとき、また、寝ているときでさえ私たちの体は常にエネルギーを必要とします。私たちの体がエネルギーとして使っているものはATPといわれる高エネルギー化学物質です。もし私たちの体の中でATPが作られなくなったらすぐに死んでしまうでしょう。またその供給量が少なくなったら体がうまく働かなくなって元気がなくなったり、疲れやすくなったり、代謝がうまくいかなくなったり、老化が進んだり、色んな病気になってしまうでしょう。
ではエネルギーの元であるATPはどこで作られているのでしょう。そのほとんど(80~90%)はミトコンドリアというところで作られています。ミトコンドリアという言葉は最近書物やテレビなどでよく取り上げられていますのでご存知の方も多いのではないでしょうか(文献1)。
ミトコンドリアというのはほとんどの細胞の中にある小器官のひとつで、その量は消費されるエネルギーと関係があり、エネルギーをたくさん使う部位(組織や臓器)の細胞にはミトコンドリアの量も多く存在します。体内のエネルギーの4割を消費する骨格筋ではたくさんのミトコンドリアが見られます。特に心臓には臓器の中で一番多くのミトコンドリアが存在します。これは心臓がいつも動いているからでエネルギーを最も多く使うからです。このようにミトコンドリアは細胞に必要なエネルギーのほとんどを生成するために、細胞内の”発電所”と呼ばれています。
実際の発電所(火力)では、燃料として主に石炭、石油、天然ガスを使いますが、ミトコンドリアでは食物として摂取した脂肪、炭水化物、タンパク質が燃料となります。実際にはそれらが消化吸収された脂肪酸、グリセロール、グルコースなど(糖類)、アミノ酸が燃料となります。それらが利用されやすい形に変えられて、ミトコンドリア内で酸素と反応してエネリギーであるATPを生成します。これはミトコンドリアから細胞内に放出されてエネルギーとして使われます。上に述べましたように多くのエネルギ-を必要とする細胞には多くのミトコンドリアが存在します。
一方、ミトコンドリアで食物の酸化によって生じたエネルギーの一部は熱として放出されます。これは体温の維持に使われます。熱産生に特化した細胞に褐色脂肪があります。褐色脂肪組織は特に体内で熱発生が必要な時〔寒冷下におかれた時など(非ふるえ産熱)〕活発に活動します。この組織には特にミトコンドリアの量が多いことが知られています。ここでは特にグルコースと脂肪酸の両者の酸化が活発です。褐色脂肪組織ではこれらの酸化によって得られたエネルギーはほとんどが熱になり、ATPの生成はわずかにすぎません。興味あることに肥満の人では褐色脂肪組織が減少しているかほとんど無いといわれています。
このように私たちの体に必要なエネルギー(ATP)のほとんどはミトコンドリアで生成されることが分かりました。ではこのミトコンドリアに異常がおこったり、数が少なくなったらどうなるでしょうか。その場合、ミトコンドリアの働きが悪くなったり不足したりして、体に必要なエネルギーは不足し、様々な影響が出てきます。例えば、少し~中程度に不足した場合は、疲れやすくなったり、疲労が抜けにくくなったり、頑張りが効かなくなったり、太りやすくなったり(食べたものが消費されにくくなって脂肪として蓄積されやすくなります)、老化が進んだり(代謝が悪くなるため)すると考えられます。それが持続すると老化病、肥満、糖尿病などを引き起こす原因となり、寿命も短くなると考えられます。また最近では、ミトコンドリアの異常とがんの転移やアルツハイマー病が関係あることが言われています。実際、老化によってミトコンドリアの数や機能が低下することが知られています。
(文献)
1)例えば、古くは「パラサイト・イヴ」(瀬名秀明のデビュー作となったホラー小説)、最近では「ミトコンドリアの新常識」(NHKサイエンスゼロ、2011年)、「ウェスト20cm減、体重15kg減!ミトコンドリア・ダイエット」(内藤眞禮生、2012年)など。
1-2-2)ミトコンドリアと老化および老化病、肥満、メタボリックシンドロームとの関係
a)ミトコンドリアと老化および老化病
ミトコンドリアは細胞のエネルギー生産を担う重要な細胞内小器官で、二重の生体膜で包まれ独自のDNAを持っています。老化の原因として注目されているものに「ミトコンドリアフリーラジカル説」があります。それによると、加齢に伴って蓄積されるミトコンドリアDNA(mtDNA)、タンパク質、内膜、外膜の酸化損傷がミトコンドリアの機能を低下させ、それが老化の原因になると考えられています(文献1)。
ミトコンドリアではATPを生産する過程において、酸化に使われた酸素の一部が活性酸素(スーパーオキシド)に変わります。成人1人が1日に消費する酸素は700リットル程度と言われていますが、そのうち3~5%が活性酸素に変わると言われています(文献2)。また、そのうちおよそ90%の活性酸素がミトコンドリアで生成されます(文献1)。活性酸素はATPの生産量が多いほど多く生成します。例えば、運動するとより多くのATPを必要とするため、より多くの活性酸素が発生します。ミトコンドリアには活性酸素を消去するシステムが備わっていますので、これが十分働いている若い細胞のミトコンドリアでは通常活性酸素は消去され問題は生じません。ところが、激しい運動をしたりして大量の活性酸素が生じ防御システムの限度を超えたり、加齢によって防御システムの働きが低下してきますと、ミトコンドリア内に活性酸素が残存し、それがミトコンドリアのタンパク質、mtDNAあるいは膜の酸化損傷を引き起こし、ミトコンドリアの機能障害(ATPの生産低下、活性酸素の生成増加など)や形態異常などが起こると考えられています。これが細胞の老化、ついで個体の老化の促進や寿命の短縮を引き起こすものと考えられています。
では、ミトコンドリアが異常を起こすとどういう老化現象が生じるのでしょうか。ミトコンドリアDNAの修復機能を欠失した異常なミトコンドリアを持つ遺伝子改変マウスでは、脱毛、白髪化、脊柱後わん症、胸腺退縮、睾丸萎縮による精祖細胞の空乏、骨量の低下、腸陰窩、赤血球の循環障害、体重低下、筋肉減少症など老化に特異的な症状を示しました。また、寿命においては、正常型のマウスに比べ平均寿命が半分以下に短縮されました。これらの結果から、ミトコンドリアの異常が老化を促進し、寿命を短くすることが明らかになりました(文献1)。
一方、ミトコンドリアの抗酸化防御能を高めた場合には寿命は延びるのでしょうか。ミトコンドリアの抗酸化防御能を高めたトランスジェニックマウス(遺伝子導入マウス)は普通のマウスに比べ寿命が2割も伸びました。また、このようなトランスジェニックマウスでは老化に伴う病変も軽度でした。
このように、ミトコンドリアの異常による機能低下は、エネルギー(ATP)の生成を低下させたり、活性酸素の生成を増加させたりして、細胞や個体の機能を低下させ、老化を促進し寿命を短くします。一方、ミトコンドリアの活性増加や異常の抑制は老化を抑制し寿命を延ばすことが明らかとなりました。
では、私たちはどういうことに気を付けて生活すれば、ミトコンドリアを活性化し、老化を抑え寿命を延ばすことができるでしょうか?
現在最も確実に老化を抑え寿命を延長する方法はカロリー制限です。カロリー制限によって、がん、動脈硬化、糖尿病などの老化病にも罹りにくくなることが知られています。カロリー制限による寿命延長に関与する主要な因子としてサーチュインが注目されています(文献1)。最近の研究では、カロリー制限は、eNOS〔アルギニンから一酸化窒素(NO)を合成する一酸化窒素合成酵素(NOS)の一つで、血管内皮細胞で見出された〕を誘導することが報告されています。eNOSの誘導によって生成増加したNOは、白色脂肪、褐色脂肪、脳、肝臓、心臓などの組織や器官で、ミトコンドリアタンパク質、ミトコンドリアDNA(mtDNA)、酸素消費およびATP合成を増やします。また、NOはサーチュイン(SIRT1)を活性化することが知られています。サーチュインは細胞の寿命延長に重要と考えられています。さらにサーチュインは、PGC-1α(ミトコンドリアの合成を促進する因子)を増やし脂肪細胞でミトコンドリアの合成を促進します。サーチュインはまた抗酸化酵素を誘導します。カロリー制限はミトコンドリアの合成を増やします。NOは脂肪酸の酸化、脂肪分解を増やし、脂肪の蓄積を減少させ、老化や老化病を予防したり寿命の延長に寄与します。以上のことをまとめてみますと、カロリー制限はeNOSを活性化し、NOを増やします。NOはサーチュイン(SIRT1)を活性化し、PGC-1αを増やします。PGC-1αは遺伝子に働いてミトコンドリアの合成を促進します。細胞はミトコンドリアが増えることで、脂肪酸酸化、脂肪分解が増加し、脂肪の蓄積が減少し、酸素消費が増え、ATPの生成が増加します。一方、ミトコンドリアが増えたり働きが高まると活性酸素の生成が増え、酸化ストレスにより細胞が障害されてかえって老化が促進されるのではないかと考えられますが、サーチュインは抗酸化酵素を誘導しますので酸化ストレスを低減すると考えられます。これらによって、老化が抑制され、動脈硬化、糖尿病、がんなどの老化病に罹りにくくなり寿命が延長するものと考えられます(文献3、4)。(図1)。
UCL (University College London)(資料5)のDr Nick Laneは、「もし長生きしたければ、そして老化や老化病に罹りたくなければもっとミトコンドリアを増やしなさい」と述べています(文献3)。現代社会において私たちがカロリー制限を一生続けていくのは極めて困難です。そのため、ミトコンドリアを増やす現在最も良い方法の一つはNOを増やすことです。これによって、老化あるいは老化病を一気に予防・改善することが期待できます。これは現在の医薬品では不可能です。つまり現在医薬品には抗老化薬や長寿薬はありませんが、NOを増やすものがあればそれが抗老化薬や長寿薬になる可能性が非常に高いと考えられます。
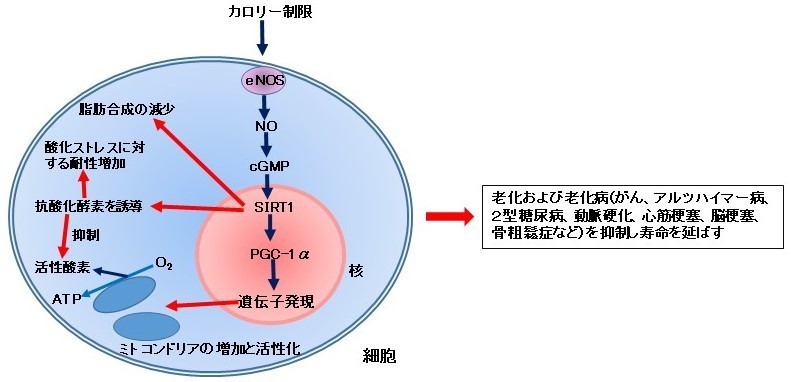
【図1の説明】
カロリー制限はeNOSを活性化し、NOを増やします。NOはサーチュイン(SIRT1)を活性化し、PGC-1αを増やします。PGC-1αは遺伝子に働いてミトコンドリアの合成を促進し、それを活性化します。その結果、脂肪酸酸化、脂肪分解が増加し、脂肪の蓄積が減少し、酸素消費が増え、ATPの生成が増加します。また、サーチュインは脂肪合成を減少させます。一方、ミトコンドリアが増えたり働きが高まると活性酸素の生成が増え、酸化ストレスにより細胞が障害されてかえって老化が促進されるのではないかと考えられますが、サーチュインは抗酸化酵素を誘導しますので酸化ストレスを低減すると考えられます。これらによって、老化が抑制され、動脈硬化、糖尿病、がんなどの老化病に罹りにくくなり寿命が延長するものと考えられます。(文献3の図を改変)
(文献、資料)
1)「老化・寿命のサイエンス」(実験医学増刊、2013)。
2)「ハーパー・生化学」(原書29版)(丸善出版、平成25年)。
3)"Nitric oxide and mitochondrial biogenesis" J. Cell Sci., 119, 2855 (2006).
4)「アンチエイジング医学の基礎と臨床」(日本抗加齢医学会。2011年)
5)UCLは、イギリスを代表する研究志向の総合大学である。2013年のQS世界大学ランキングで世界第4位。その時東京大学は32位。現在までUCLは卒業生、教員、創立者から20人以上のノーベル賞受賞者を輩出している。(ユニヴァーシティ・カレッジ・ロンドン。ウィキペディアより)
b)ミトコンドリアと肥満
肥満は、消費エネルギーよりも摂取エネルギーが多いときに余ったエネルギーが脂肪として蓄えられることによって生じます(肥満については「絶対やせる!ダイエットの決め手はこれだ!」も参照ください)。肥満は、インシュリン抵抗性(高血糖になります)、2型糖尿病、動脈硬化、高血圧、睡眠障害、ある種のがんの主な原因となります。これらはいわゆる生活習慣病と呼ばれ、その有病率は増加し続けており、その治療に使われる医療費はいまや全医療費の約3割を占めるまでになっています。(厚生労働省統計資料)
肥満はこのようにメタボリックシンドロームや生活習慣病の主な原因となりますが、一方で、特に容姿を気にする女性にとっては肥満は最も悩ましく避けたいことの一つと言えます。そのため、色んなダイエット法やサプリメントが現れ、ダイエット本もベストセラーになるほど売れていますが、これぞというものはほとんどなく、出ては消え去っていくのがほとんどです。これは提唱されてきたダイエット法やサプリメントがほとんどが感覚的、イメージ的で、提唱者の思い込みや体験談によるもので、理論的な背景やデータに乏しいためと考えられます。そのため、このようないかがわしいダイエット法やサプリメントにだまされることなく(またテレビや雑誌などの広告にだまされることなく)、如何に普遍的で確実なダイエット法を見つけられるかどうかが、自分のダイエットを成功させるためには大変重要なこととなります。以下、これまで提唱されてきたダイエット法に比べ、はるかに理論的、実際的に優れたダイエット法をご紹介します。それは、肥満の原因論に根差した方法で最近学会等で急速に注目されてきている方法です。この方法はそのやり方さえ間違えなければ確実に痩せることができる方法と考えられます。
肥満の原因は言うまでもなく消費エネルギーに比べ摂取エネルギーが多いことによりますが、一方で食事量(摂取カロリー量)は同じでも太る人と太らない人がいるのも事実です。この差をもたらす原因は何でしょうか。この原因が明らかになりそれに対する対策がとれるようになれば、単にダイエットするだけよりもより容易に、そしてより確実に肥満を防いだり、やせたりすることができるようになるでしょう。また、少々食べ過ぎても太らずにすむかもしれません。
肥満者ではエネルギー(ATP)の生成が低下しています。体のエネルギー生成が低下すると体はエネルギーを要求するために食欲が増加します。これによって肥満者はさらに肥満になります。いわゆる悪循環です。また、肥満者では運動能力の低下と易疲労性(疲れやすい)が見られますが、これは骨格筋でのATPレベルの低下と関係しています。ラットでの検討では、運動能力の低下したラットではより多くの内臓脂肪の蓄積が見られ、血圧、インシュリン抵抗性、血中中性脂肪なども高値でした。また、興味深いことに、運動能力の低下したラットでは、酸化的代謝の低下やミトコンドリア遺伝子発現の低下などのミトコンドリアの異常が見られました。このことは、運動能力の低下したラットでの内臓脂肪増加やその他の異常は、ミトコンドリアの合成や酸化的代謝の低下によるATP合成の低下が原因と考えられました(文献1)。
肥満の動物モデルを用いた研究から、肥満モデルでは、白色脂肪組織、褐色脂肪組織、ヒラメ筋においてeNOS〔アルギニンから一酸化窒素(NO)を合成する一酸化窒素合成酵素(NOS)の一つで、血管内皮細胞で見出された〕の発現が著しく低下していました(それによってNOの生成量が低下します。NOはPGC-1αなどの働きを介してミトコンドリアの合成と機能を高めますので、NOの生成量が低下しますとミトコンドリアの合成と機能が低下し、酸化的代謝とATP合成の低下が生じます)。また、酸素消費(酸化的代謝)やATP合成が低下するとともに、ミトコンドリアDNA(mtDNA)、呼吸に関係するたんぱく質、PGC-1α(ミトコンドリアの合成を促進する因子)などのミトコンドリアの合成や機能に関係する因子が低下していました。人においても、体脂肪やBMIが高い人ほど骨格筋のeNOSの量がより低下していました(文献1)。
これらの結果は、eNOS活性の低下(NO生成が低下)とそれに引き続くミトコンドリアの異常(酸化的代謝やATP合成の低下)が肥満の原因であると考えられました。
では、NOはエネルギー代謝やミトコンドリアにどのような影響を示すのでしょうか。上に述べましたように(「a)ミトコンドリアと老化および老化病」)、NOはPGC-1αを活性化します。PGC-1αはミトコンドリアの合成と機能を高めますが、実際NOはミトコンドリアの合成を促進しました。褐色脂肪細胞(この細胞では脂肪酸などを燃やして熱に変えます。この働きが悪いと肥満になります)、骨格筋細胞など種々の細胞でNOはミトコンドリアの合成や機能(酸化的リン酸化など)を高め、ATP合成を促進します。肥満者ではATPの合成が低下し、これが肥満の原因になりますが、ミトコンドリアの数の減少と機能の低下がATP合成の低下をもたらすために、NOによってミトコンドリアの合成と機能が高まるということは、NOは肥満の原因を根本から改善する理想的な抗肥満因子であると言えます。
NOはミトコンドリアの合成と機能を高めますが、それに加えてミトコンドリアのエネルギー(ATP)生産を助ける、あるいは脂肪の蓄積を妨げる様々な働きをすることが示されました。これらの働きは肥満の抑制に働きます。例えば、NOはミトコンドリアへのエネルギー物質(脂肪酸など)の輸送を阻害する物質の濃度を低下させます。また、脂肪形成に関係のある遺伝子の発現を低下させます。NOはcGMPを介してリパーゼの活性を高め、白色脂肪組織での脂肪分解を促進します。NOは血流を促進し、脂肪酸、ブドウ糖および酸素の組織への供給を増加し、その結果ミトコンドリアでのこれらエネルギー物質の酸化を増加させます。
褐色脂肪組織(褐色脂肪細胞)は、ブドウ糖や脂肪酸を燃やして熱に変えますが、その働きは体熱の維持や不要なエネルギー物質(ブドウ糖や脂肪酸)の消費などに大変重要です。例えば寒冷刺激による熱産生は主に褐色脂肪組織(褐色脂肪細胞)において行われます。この組織(細胞)の働きが低下すると不要なエネルギー物質(ブドウ糖や脂肪酸)は燃やされることなく残ることになりこの余分なエネルギーは脂肪などとして蓄積され肥満を誘導します。そのため、褐色脂肪組織(褐色脂肪細胞)をうまく増やすことができれば肥満を抑制できることになります。PGC-1αはミトコンドリアの合成を高めるとともに褐色脂肪組織(褐色脂肪細胞)を増やす働きを示します。NOはPGC-1αを活性化します。つまり、NOはPGC-1αを刺激し褐色脂肪組織(褐色脂肪細胞)を増やします。それによって不要なエネルギー物質を熱に変え肥満を抑制します。人において、褐色脂肪組織(褐色脂肪細胞)の活性は肥満体の人では低下していることが知られています。そして、褐色脂肪組織(褐色脂肪細胞)の活性が高い人は基礎代謝量も高いです。また、褐色脂肪組織(褐色脂肪細胞)の活性が高い人はBMIや白色脂肪、内臓脂肪が少ないことが明らかにされています。褐色脂肪組織(褐色脂肪細胞)の活性は年齢に依存します。つまり褐色脂肪組織(褐色脂肪細胞)の活性は若い人(23~35歳)に比べ年齢が高い人(36~65歳)では低下していました。このことが同じカロリーの食事をしても若い時に比べ年を取ると太りやすくなる原因となると考えられます(文献2)。
以上をまとめますと、NO〔NOはアルギニンを原料としてNO合成酵素(NOS)という酵素の働きで生成します〕はcGMPを介してPGC-1αの活性を高めてミトコンドリアの合成や機能を促進します。また、NOはリパーゼの活性を高めて脂肪の分解を促進し、血管に働いて血流を促進したりして、細胞やミトコンドリアにエネルギー物質(脂肪、ブドウ糖など)や酸素を供給しやすくします。これによってブドウ糖や脂肪酸などを酸化してエネルギー(ATP)に変える能力を高めます。加えて、NOは褐色脂肪組織(褐色脂肪細胞)を増やしその活性を高めます。褐色脂肪組織(褐色脂肪細胞)ではエネルギー物質は酸化され熱に変換されます。一方、NOは脂肪形成を抑制します。NOはこれらのメカニズムにより強力に脂肪の蓄積を抑えたり脂肪を減少させたりすることで、肥満を抑制したり体脂肪を減らすと考えられます(図2)。
図2.アルギニン(NO)が体脂肪を減少させ肥満を抑制することについて考えられるメカニズム
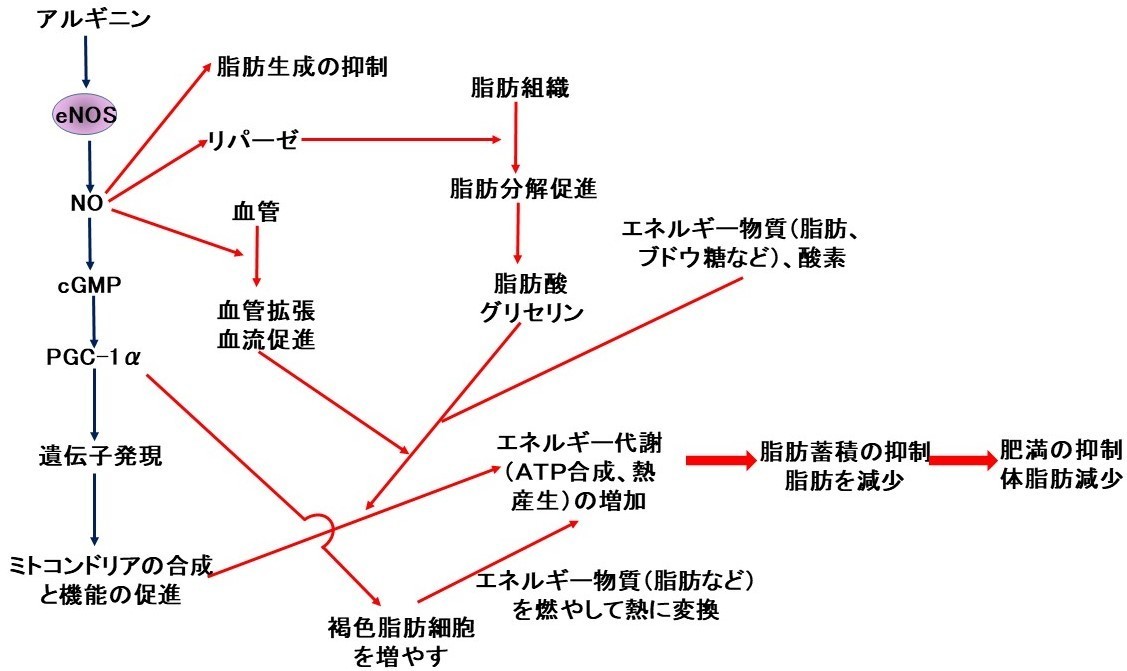
【図2の説明】
アルギニンからeNOSの働きで生成したNOは、cGMPの合成を促進し、次いでPGC-1αを活性化し、ミトコンドリアの合成と機能を促進します。また、NOはリパーゼの活性を高めて脂肪の分解を促進し、血管に働いて血流を促進したりして、細胞やミトコンドリアにエネルギー物質(脂肪、ブドウ糖など)や酸素を供給しやすくします。これによってブドウ糖や脂肪酸などを酸化してエネルギー(ATP)に変える能力を高めます。加えて、NOは褐色脂肪組織を増やしてその活性を高めます。褐色脂肪組織ではエネルギー物質は酸化され熱に変換されます。一方、NOは脂肪生成を抑制します。NOはこれらのメカニズムにより、強力に脂肪の蓄積を抑えたり、脂肪を減少させたりすることで、肥満を抑制したり体脂肪を減らすと考えられます。(文献1,2の図を改変)
(文献、資料)
1)"Defective mitochondrial biogenesis. A hallmark of the high cardiovascular risk in the metabolic syndrome?" Circ. Res., 100, 795 (2007).
2)"Nitric oxide and energy metabolism in mammals" BioFactors, 39, 383 (2013).
c)ミトコンドリアとメタボリックシンドローム
メタボリックシンドロームとは、肥満、特に内臓に脂肪が蓄積した肥満(内臓脂肪型肥満といいます)が原因となって血圧高値、血清脂質異常、高血糖などのさまざまな代謝異常が引き起こされた状態を言い、近年大変注目されるようになってきました。(メタボリックシンドロームについて詳しくは「アルギニンはメタボリックシンドロームを強力に予防・改善します!」を参照ください)。
年齢や肥満の進行とともにこれらの代謝異常の頻度や重症度は急激に増加し、その多くは高血圧、高脂血症、糖尿病に移行し、これらの疾患が原因となって動脈硬化が進行した結果、心血管病(心筋梗塞、脳梗塞、腎不全など)で死亡するということになります。
メタボリックシンドロームの主要な原因である内臓脂肪型肥満はどうして起こるのでしょうか。そのメカニズムとしていろいろ考えられますが、その中で細胞代謝の異常がカギとなることが提案されてきました。特に酸化的エネルギー代謝〔糖質、脂質、アミノ酸などを酸化してエネルギー(ATPなど)を得る働き〕の障害が内臓脂肪の増加に関係していることが考えられてきました。酸化的エネルギー代謝は主にミトコンドリアで行われるので、メタボリックシンドロームではミトコンドリアの機能が低下している可能性があります。すなわち、何らかの原因でミトコンドリアの機能が低下し、それがエネルギー代謝(ATPの生成や褐色脂肪組織での熱産生など)の異常(低下)を引き起こし、過剰になったエネルギー物質(脂肪、糖分など)が脂肪として蓄積され(特に内臓脂肪として)、肥満(特に内臓脂肪型肥満)、次いでメタボリックシンドロームを引き起こしたと考えられます。
糖尿病や高血糖の人では筋肉において酸化的リン酸化(ミトコンドリアでATPを合成する反応)に関係する遺伝子の発現が低下していることが示されています。そのような人ではまた、PGC-1α(ミトコンドリアの合成や機能などを促進する因子)の発現が低下していることも示されています。これらのデータはPGC-1αの発現の低下がエネルギー代謝やミトコンドリアの合成や機能に関わる遺伝子の発現を低下させ、高血糖や糖尿病、あるいは肥満のような代謝異常に関係していることを示しているものと考えられました。また、メタボリックシンドロームと関係がある遺伝子の解析が脂肪細胞を用いて検討されました。その結果、メタボリックシンドロームでは患者の内臓脂肪においてミトコンドリアの合成と機能の低下がみられると考えられました(文献1)。
ではメタボリックシンドロームにおけるミトコンドリアの合成と機能の低下はどうして起こるのでしょうか。eNOS(血管内皮細胞で見出されたNOS。NOSはアルギニンからNOを合成する酵素)を遺伝子工学的に作れなくしたマウスにおいて、人間のメタボリックシンドロームと似たような代謝異常を起こすことが見出されました。このマウスは高血圧、インスリン抵抗性(高血糖の原因の一つ)、脂質異常を示しました。このマウスではまた体重が増加し、顕著な内臓脂肪の蓄積が見られました。このマウスの酸素消費は低下しました。このことは褐色脂肪細胞の熱産生が低下していることを示唆しました。eNOSが作られないマウスと正常なマウスを比較しますと、食物の摂食量は同じでしたが、体重はeNOSが無いマウスのほうが増加しました。このことはeNOS欠損マウスではエネルギー消費量が低下しているために、同じ食事量をとっても体重がより増加したものと考えられました。組織学的検査を行いますと、このマウスでは褐色脂肪組織はほとんど機能していませんでした。また、このマウスではミトコンドリアの合成と機能が低下していました。これらのことはeNOSがミトコンドリアの合成や機能の促進に、そして、体重や内臓脂肪の増加抑制に、加えてメタボリックシンドロームの抑制に極めて重要であること、並びに、何らかの原因でeNOSの働きが低下(NOの生成が減少)することがメタボリックシンドロームを引き起こす原因となることが示唆されました(文献1)。
では次にNOを増やせばミトコンドリアの機能はどうなるでしょうか。NOは褐色脂肪細胞や白色脂肪細胞のミトコンドリアDNA(mtDNA)の量を増やしました(ミトコンドリアの合成が増加)。NOによるミトコンドリアの合成は褐色脂肪組織、心臓や骨格筋においてPGC-1αの活性化によって起こっていました。またミトコンドリアの合成はcGMP(NOによって生成が増加)に依存していました(文献1)。
なお、NOはeNOSを活性化することによって増やすことができますが、寒冷刺激や運動などによってeNOSは活性化されます。
以上のことから、寒冷刺激、運動などはeNOSを活性化してNOを増やし、次いでcGMPを増加させ、PGC-1αを活性化し、ミトコンドリアの合成と機能を高め、エネルギー代謝(ATP合成、熱産生)を増やし、肥満、特に内臓脂肪型肥満を抑制し、メタボリックシンドロームを抑制するものと考えられます(図3)。
図3.寒冷刺激、運動などによる肥満(特に内臓脂肪型肥満)およびメタボリックシンドロームの抑制について考えらるれメカニズム
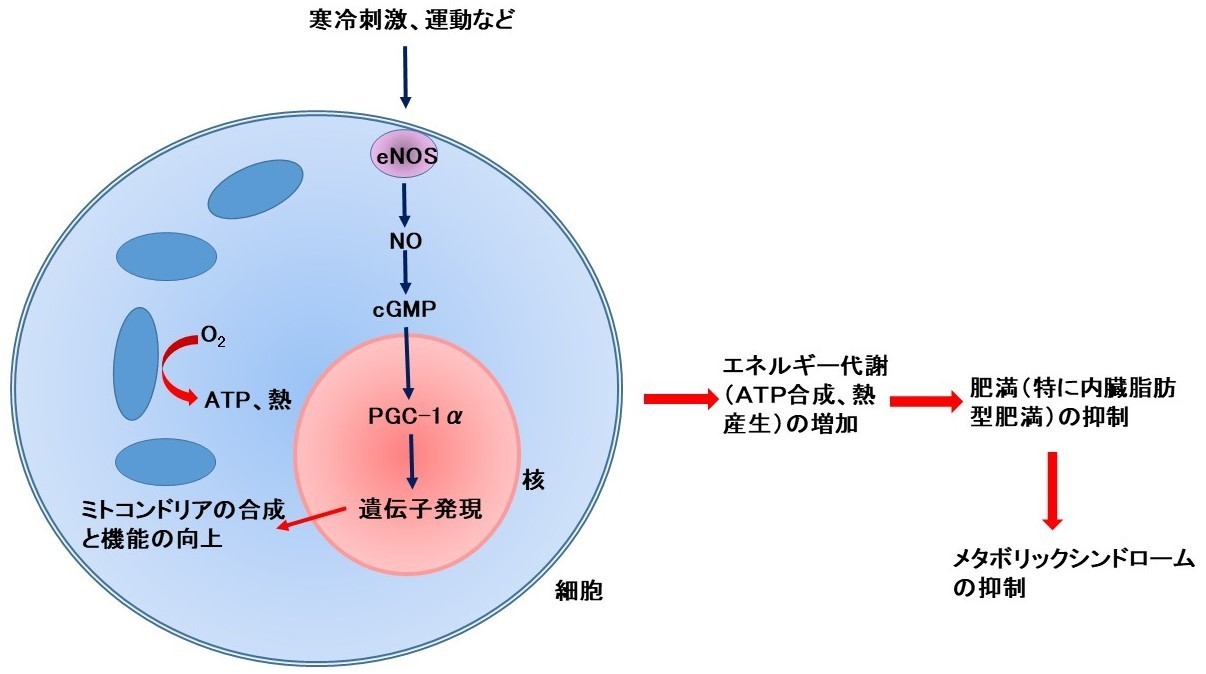
【図3の説明】
寒冷刺激、運動などはeNOSを活性化してNOを増やし、次いでcGMPの合成を促進し、PGC-1αを活性化し、ミトコンドリアの合成と機能を高めます。その結果、エネルギー代謝(ATP合成、熱産生)は増加し、肥満、特に内臓脂肪型肥満を抑制し、メタボリックシンドロームを抑制するものと考えられます。(文献1の図を改変)
(文献、資料)
1)"Defective mitochondrial biogenesis. A hallmark of the high cardiovascular risk in the metabolic syndrome?" Circ. Res., 100, 795 (2007).
「1-2-2)ミトコンドリアと老化および老化病、肥満、メタボリックシンドロームとの関係」で述べましたように、NO(生理学的量)はミトコンドリアの合成と機能を高めて、老化や老化病(糖尿病、動脈硬化、心筋梗塞、脳梗塞、アルツハイマー病、骨粗鬆症、がんなど)、メタボリックシンドローム、肥満などを抑制します。NOはアルギニンを原料としてNOS(NO合成酵素)という酵素の働きで生成されますのでNOSの働きが低下するとNOが生成されなくなり種々の異常や病気を引き起こしやすくなります。例えば、eNOS(血管内皮細胞で見出されたNOS)を遺伝子工学的に作れなくしたマウスにおいては、ミトコンドリアの合成と機能の低下〔エネルギー(ATP)が作られ難くなり、体力の低下、老化や老化病の発現や促進などが起こります〕、褐色脂肪組織の機能の低下(脂肪などを燃やして熱に変える働きが低下します)、体重増加(顕著な内臓脂肪の蓄積)、高血圧、インスリン抵抗性(高血糖の原因の一つ)、脂質異常などの代謝異常や病気を引き起こしました。これらの現象は老化やメタボリックシンドロームに一般的に見られるもので、これが慢性的に進行すると老化病と言われる糖尿病、動脈硬化、心筋梗塞、脳梗塞、アルツハイマー病、骨粗鬆症、がんなどに移行するものと考えられます。従って、NOS(eNOS)の働きを高めることによってNOの生成が増加し、ミトコンドリアの合成と機能が高まり、老化や老化病、メタボリックシンドローム、肥満などが抑制できるものと考えられます。
NOS(eNOS)を活性化する方法にはカロリー制限、寒冷刺激、運動、アルギニンなどがあります。その中でアルギニンはアミノ酸の一種でタンパク質の原料として体の中でも作られますが、不足量は食事(タンパク質)として摂取しています。ところが最近の研究では、加齢や生活習慣の乱れ(飲み過ぎ、ストレス、運動不足、喫煙、ダイエットなど)によって、また、老化病や生活習慣病で、体内でのアルギニンの量や働きが低下するとの報告があり、これが老化や老化病、生活習慣病の大きな原因の一つになっている可能性があります。つまりアルギニンの不足が老化や老化病や生活習慣病を引き起こしている可能性が指摘されています。この理由はアルギニンがタンパク質の原料としてだけではなく、体の中で様々な働きをしているためです。アルギニンの働きの一つにNOを生成する働きがあります。アルギニンはNOSの原料となりますが、同時にNOS(eNOS)を活性化することが知られています。アルギニンによって活性化されたNOS(eNOS)はNOの生成を増加させます。生成したNOはミトコンドリアの合成と機能を高めたり、その他種々の働きを示し、老化や老化病(糖尿病、動脈硬化、心筋梗塞、脳梗塞、アルツハイマー病、骨粗鬆症、がんなど)、メタボリックシンドローム、肥満などを抑制すると考えられます。
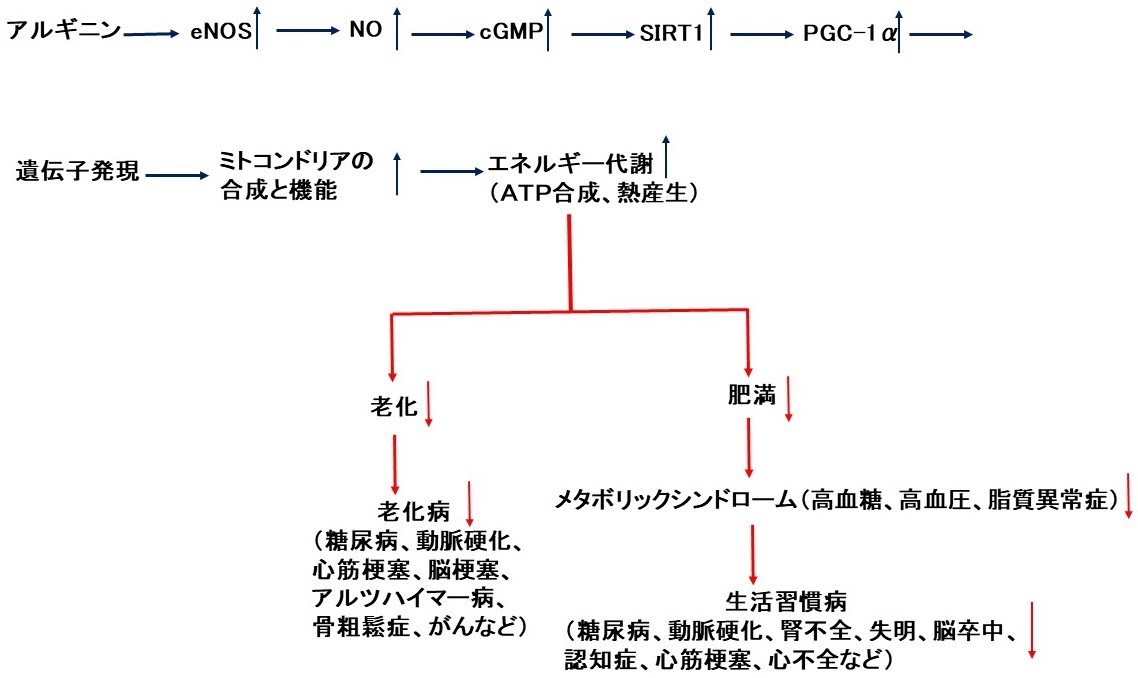
実際、アルギニンはNOSの発現を増加させ、NOとcGMPの生成を増加させました(文献1、2、3)。また、アルギニンは、PGC-1α(ミトコンドリアの合成と活性をコントロールする重要な因子)の発現を増加させ、ミトコンドリアの合成を促進しました(文献3、4)。加えて、アルギニンは、サーチュイン(SIRT1)の発現を増加させました(文献5)。
これらの結果から、アルギニンはeNOSを活性化し、NOの生成を増加し、cGMPの合成を促進します。次いでSIRT1の発現を増加させ、PGC-1αの発現を増やし、ミトコンドリアの合成と機能を高めます。これによって生体のエネルギー代謝(ATP合成、熱産生)が促進され、老化や老化病、肥満やメタボリックシンドローム、あるいは生活習慣病が予防・改善されるものと考えられます(図4)。

(文献、資料)
1)"Defective mitochondrial biogenesis. A hallmark of the high cardiovascular risk in the metabolic syndrome?" Circ. Res., 100, 795 (2007).. .
2)"Beneficial effects of a long-term oral L-arginine treatment added to a hypocaloric diet and exercise training program in obese, insulin-resistant type 2 diabetic patients" Am J Physiol Endocrinol Metab, 291, E906 (2006).
3)"Dietary L-Arginine Supplementation Reduces Fat Mass in Zucker Diabetic Fatty Rats" J Nutr, 135, 714 (2005).
4)"Regulatory roles for L-arginine in reducing white adipose tissue" Front Biosci, 17, 2237 (2012).
5)"A Novel Role for SIRT-1 in L-Arginine Protection against STZ Induced Myocardial Fibrosis in Rats" PLOS ONE, 9, e114560 (2014).
【その他のサーチュイン活性化物質(特にレスベラトロールについて)】
すでに述べましたように(「1-2)長寿遺伝子説」を参照ください)、サーチュインを活性化することが老化や寿命延長に寄与するだろうとの考えのもと、サーチュイン活性化物質が広く探索されました。その結果、多くの物質がサーチュインを活性化することが見出されましたが、動物だけではなく人でもその働きが明らかで、長期摂取に適した安全性の高い物質はまだほとんどないのが現状です。その中で、ブドウなどに含まれる天然物質であるレスベラトロールが動物実験では比較的検討されていますが、人でのデータはまだ限られており、またカロリー制限の効果を十分に再現できる結果はほとんど得られていません(文献1、2、3、4、5)。
例えば、カロリー制限では、通常食の時よりも寿命を延長しますが、レスベラトロールは通常食の場合寿命を延長する効果は示されておりません(次の参考例。文献3)。また、動物実験では循環系、代謝系(メタボリックシンドローム、糖尿病など)、筋肉系、神経系(認知症など)、がんなどに比較的多くのデータが得られておりますが、人の対するデータは非常に乏しいのが現状です(文献1、2、3、4、5)。
1.レスベラトロールの効果
◎レスベラトロールの効果の検討例(試験管内、動物試験)(文献1、2、3、4、5)
レスベラトロールに関しては、非常に多くの試験管内や動物を用いた基礎的な研究がなされ、その作用がかなり明らかにされてきました(文献4)。これらの検討結果から、レスベラトロールは、SIRT1の活性化のみならず、抗酸化作用、抗炎症作用、eNOS活性化作用(NO生成増加)、テロメラーゼ活性化作用などを示すことが報告されています。また、動物などを用いた試験において、血圧低下作用、インスリン抵抗性改善作用(インスリン感受性増強作用)、血糖低下作用、コレステロール低下作用、中性脂肪低下作用、認知機能増加作用などが報告されています〔レスベラトローの循環系、代謝系(メタボリックシンドローム、糖尿病など)、筋肉系、神経系(認知症など)、がんなどに対する効果についてより詳しくお知りになりたい方は文献1、2、3、4、5などをご参照ください〕。
例えば、レスベラトロールの寿命延長効果がマウスを用いて検討されました(文献3)。年齢が1歳のマウス(通常食で飼育した時のこのマウスの平均寿命は2.5年ほどです)を通常食〔自由摂食または隔日摂食(カロリー制限に相当)〕または高脂肪高カロリー食で飼育しました。またそれぞれの場合にレスベラトロールを餌に混ぜて摂食させました。マウスの体重は通常食のマウス(平均約35g)に比べカロリー制限マウス(平均約30g)では約14%低下していました。一方高カロリー食のマウス(平均約47g)では通常食マウスより約34%増加していました。通常食マウスとカロリー制限マウスではレスベラトロールの摂取によって体重に影響はありませんでしたが、高カロリー食マウスではレスベラトロールの摂取によって体重はより増加しました(平均約51g、約9%の増加)。このように、レスベラトロールには体重減少効果は認められないどころか、高カロリー食を摂取している肥満マウスではかえって体重は増加しました。
次に寿命に対する食事の影響ですが、カロリー制限マウスでは通常食マウスに比べ平均寿命は延長する傾向にありました(約4%の延長)。一方、高カロリー食マウスでは通常食マウスに比べ平均寿命は短くなりました(約10%の短縮)。このことから高カロリー食による肥満は寿命を短くすることが明らかとなりました。一方、レスベラトロールを摂取させた場合、通常食のマウスやカロリー制限のマウスにおいて寿命に影響は見られませんでした。なお、高カロリー食マウスではレスベラトロールの摂取によって寿命は通常食マウスのレベルまで延長しましたが、それ以上の延長は見られませんでした。
以上の結果から、レスベラトロールは、通常食を摂取している場合体重にはほとんど影響しませんでしたが、高カロリー食を摂取している肥満の状態ではかえって体重を増加させました。また、通常の食事をしている場合レスベラトロールは寿命には影響しませんでしたが、高カロリー食を摂取している場合短くなった寿命を通常食レベルまで回復させました。これらのことから、レスベラトロールは通常の食生活をしている場合寿命に影響するほどの働きはしませんが、食べ過ぎなどで肥満体になり、肥満による種々の病気を併発するようになった場合は非肥満レベルまで健康を回復させる可能性があるということになると考えられます(但し、肥満時にレスベラトロールを摂取するとさらに肥満になる可能性がありますが)。
◎レスベラトロールの人における効果(臨床効果)
一方、人を用いた臨床試験はまだかなり限られており、また、現在のところその結果も期待されたほどではありません(今後データが増えてくればその評価も変わってくる可能性はありますが)(文献4)。
例えば、IGT(耐糖能異常)の人10人(平均年齢72歳)にレスベラトロール(1日1~2g)を4週間摂取させたところ〔非盲検試験(非盲検のため試験の信頼度は劣ります)、米国〕、食後の血糖値とインスリン値の上昇が改善されましたが、体重、体脂肪、コレステロール値、中性脂肪値、アジポネクチン値、空腹時血糖値、空腹時インスリン値、収縮期血圧、拡張期血圧には影響しませんでした(文献6)。
肥満の人(平均年齢45歳、BMI32.5、デンマーク)12人にレスベラトール1.5gを4週間摂取させた試験(プラセボ対照無作為化二重盲検比較試験)において(プラセボ12人)、レスベラトロールは血糖値、HbA1c、インスリン値、コレステロール値、中性脂肪値、血圧、体脂肪などにほとんど影響しませんでした(レスベラトロールが吸収されていることは確認済み)(文献7)。
レスベラトロールの死亡率への影響を検討した結果が報告されています(文献8)。この報告は新聞や週刊誌の見出し的に表現すると”赤ワインのポリフェノールに健康長寿との因果関係なし”という赤ワイン党にはショッキングなものでした。これは、イタリアのキャンティ(Chianti)地方(赤ワインのキャンティで有名)に住む783人の高齢者(65歳以上の男女)を対象にした試験で、ブドウや赤ワインなどに含まれる、ポリフェノールの一種のレスベラトロールの体内レベルと、死亡率や心血管病、がんなどとの関係を調べたものです。その結果、レスベラトロールの体内濃度と死亡率、心血管病、がんなどとの間には相関関係はなかったということです。このことから、本報告は、本地域において、食事(西洋食)から摂取されたレスベラトロールは、健康状態や死亡率に本質的な影響を有しないと結論付けています。(なお、イタリアはワインの生産量、消費量ともに世界のトップスリーに入っているそうです)。
非肥満で耐糖能が正常の閉経後の女性(レスベラトロール群15人、平均年齢58.2歳。プラセボ群14人、平均年齢59.8歳。米国)を対象にした試験(プラセボ比較無作為化二重盲検試験)で、レスベラトロール(75mg/日)の12週間の摂取によって(レスベラトロールが吸収されていることは確認済み)、体重、体脂肪、血糖値、インスリン値、血圧、インスリン感受性に影響はみられませんでした(文献9)。
日本における検討では、関西医科大学グループが検討した報告があります(文献10)。メタボリックシンドロームで治療中(糖尿病、脂質代謝異常、高血圧の治療)の患者34人をグループA(レスベラトロール製品を3ヶ月間摂取後3ヶ月休止)とグループB(レスベラトロール製品を3ヶ月後から6ヶ月まで摂取)に分け、レスベラトロール製品を3ヶ月間摂取させました。その結果、本レスベラトロール製品の摂取は血圧、インスリン抵抗性、脂質プロファイル、炎症マーカーに影響しませんでした。
一方、ある程度効果があったという報告があります。健康な肥満の人(11人、平均年齢52.5歳、平均BMI31.5、オランダ)に、交互にレスベラトロール(150mg/日)とプラセボを30日間摂取させた試験(無作為化二重盲検クロスオーバープラセボ比較試験)において、レスベラトロールの摂取によって血糖値(-4%)、インスリン値(-14%)、中性脂肪(-6%)、収縮期血圧(-4%)の低下が見られましたが、体重には影響がありませんでした(文献11)。
2型糖尿病の患者(62人、インド)に対するレスベラトロールの効果が検討されました(非盲検無作為化比較試験:非盲検のため試験の信頼度は劣ります)(文献12)。患者はコントロール群とレスベラトロール群に分けられました。コントロール群は経口血糖低下剤のみを投与されました。レスベラトロール群はレスベラトロール(250mg/日)と経口血糖低下剤が投与されました。試験期間は3ヶ月でした。その結果、レスベラトロール群ではコントロール群に比較し、HbA1c(-3.4%)、収縮期血圧(-8.4%)、トータルコレステロール(-7.9%)の低下がみられました。一方、体重、HDLおよびLDLコレステロールには変化は見られませんでした。
以上の結果や他の文献(文献4)等から、レスベラトロールは、正常な人、肥満の人、メタボリックシンドロームの人の体重や体脂肪、代謝関係指標(血圧、血糖値、インスリン値、コレステロール値、中性脂肪など)にはほとんど影響しないか、マイルドな影響しか示さないと考えられます。一方、糖尿病や心血管系の疾患については効果がある可能性はありますので、今後のデータを期待したいと思います。なお、レスベラトロールが健康長寿をもたらし、老化や老化病(心血管病、がんなど)を抑制するかどうかについては、食物(ブドウやワインなど)由来のレスベラトロールとの関係は見いだせなかったという疫学研究がありますが、サプリメントとして大量摂取した場合にどうなるかについては今後の検討課題です。しかし、マウスの実験からは、正常な人の寿命を延ばすことは難しいかもしれません。
2.レスベラトロールとアルギニンの比較
アルギニンは、すでに述べましたように(「◎アルギニンとテロメラーゼの関係」および「1-2-3)ミトコンドリアとアルギニン」を参照ください。また、次に述べますように「2)摩耗説とは」を参照ください)、老化の二大原因と考えられている遺伝子説と摩耗説の両面からアタックすることで、寿命を延長し、老化や老化病を強力に抑制し、ひいては若返りも期待できると考えられます。すなわち、アルギニン(NO)は、テロメラーゼを活性化し、テロメアを長く保ちます。また、アルギニン(NO)は、長寿遺伝子(サーチュイン、SIRT1)を活性化します。さらに、アルギニン(NO)は、活性酸素や糖化を抑制します。これらの働きによって、アルギニンは、寿命を延長し、老化や老化病、肥満やメタボリックシンドローム、あるいは生活習慣病を予防・改善するものと考えられます。実際、アルギニンは、通常食において動物の寿命(生存数)を延ばし、動物や人において老化や老化病(肥満、メタボリックシンドローム、糖尿病、糖尿病合併症、動脈硬化、心血管病、ED、高血圧症、心不全、認知症、感染症、骨粗鬆症、肝障害、痔、がんなど)を予防、改善します(「2.アルギニンの寿命延長、老化および老化病の予防・改善作用」を参照ください)。
一方、レスベラトロールは、SIRT1の活性化、抗酸化作用、抗炎症作用、eNOS活性化作用(NO生成増加)、テロメラーゼ活性化作用などを示すとされていますが、通常食(マウス)において寿命延長作用は見られません。また、動物実験では循環系、代謝系(メタボリックシンドローム、糖尿病など)、筋肉系、神経系(認知症など)、がんなどに比較的多くのデータが得られておりますが、人の対するデータは非常に乏しく、人において本当に効果があるかどうかは不明なのが現状です(文献4)。
このように、現在のところ、アルギニンに比べて、レスベラトールの寿命延長、老化および老化病抑制効果は弱いように見えますが(今後データが蓄積されてくれば評価が変わってくる可能性はありますが)、その理由は、アルギニンには寿命延長、老化および老化病抑制に働く様々な作用、例えば、一酸化窒素(NO)そのものによる作用、抗糖化作用、抗酸化作用、長寿遺伝子(サーチュイン)活性化作用、テロメラーゼ活性化作用(テロメア伸長作用)などがあり、また、それらの作用の強さの面で、さらに、生体内において、より強い可能性があり、それらがアルギニンの強力な寿命延長、老化および老化病抑制に結びついているものと考えられます。
例えば、レスベラトロールは人のメタボリックシンドロームにほとんど作用を示さないか(文献10)、あってもマイルドな作用しか示さないと考えられますが、アルギニンは、人のメタボリックシンドローム(アルギニンを3週間摂取)において体脂肪(脂肪特異的)(-3.0kg)、腹囲(-8.3cm)、収縮期血圧(-15%)、拡張期血圧(-13%)、空腹時血糖値(-35%)、インスリン値(-38%)を強力に低下させ(収縮期血圧、拡張期血圧、空腹時血糖値は正常値まで低下)ました(「アルギニンはメタボリックシンドロームを強力に予防・改善します!」を参照ください)(その他のアルギニンの働きについては「2.アルギニンの寿命延長、老化および老化病の予防・改善作用」を参照ください)。
なお、レスベラトロールは赤ワインなどに比較的多く含まれており、食品(アルコール飲料)としての摂取は歴史は長いですが、サプリメントとして人が大量に摂取し始めたのは比較的最近のことであり、長期安全性が確立されたとはいえず、摂取する際にはその安全性に十分注意する必要があります(文献4)。
以上のことから、寿命延長、老化および老化病抑制を期待して長期間摂取するには、現在のところ、高い効果が期待でき、長期安全性面でも安心して摂取できるアルギニンを最もおすすめします。
(文献、資料)
1)「老化・寿命のサイエンス」(実験医学増刊、2013)。
2)「レスベラトロール」(ANTI-AGING MEDICINE、Vol.8、No.6、2012)。
3)"Resveratrol delays age-related deterioration and mimics transcriptional aspects of dietary restriction without extending lifespan" Cell Metab., 8, 157 (2008).
4)"Resveratrol and Clinical Trials: The Crossroad from In Vitro Studies to Human Evidence" Current Pharmaceutical Design, 19, 6064 (2013).
5)健康食品の安全性・有効性情報「レスベラトロール」(国立研究開発法人 医薬基盤・健康・栄養研究所)
。
6)"Pilot Study of Resveratrol in Older Adults With Impaired Glucose Tolerance" J Gerontol A Biol Sci Med Sci, 67, 1307 (2012).
7)"High-Dose Resveratrol Supplementation in Obese Men. An Investigator-Initiated, Randomized, Placebo-Controlled Clinical Trial of Substrate Metabolism, Insulin Sensitivity, and Body Composition" Diabetes, 62, 1186 (2013).
8)"Resveratrol levels and all-cause mortality in older community-dwelling adults" JAMA Internal Med, 174, 1077 (2014).
9)"Resveratrol supplementation does not improve metabolic function in non-obese women with normal glucose tolerance" Cell Metab, 16, 658 (2012).
10)"Modified resveratrol Longevinex improves endothelial function in adults with metabolic syndrome receiving standard treatment" Nutr Res, 31, 842 (2011).
11)"Calorie restriction-like effects of 30 days of Resveratrol (resVidaTM) supplementation on energy metabolism and metabolic prifile in obese humans, Cell Metab, 14, 612 (2011).
12)"Resveratrol Supplementation improves glycemic control in type 2 diabetes mellitus" Nutr Res, 32, 537 (2012).
2)摩耗説とは
人や動物など生物は有機分子でできていますが、それらは環境因子や体内損傷因子によって絶えず傷つけられています。一方、それを修復する機構が生体には備わっていますが、それは完璧ではなく修復し残した箇所が蓄積し、最終的にそれが生体機能に影響するようになり、老化や老化病や死に至るとする考えが「老化の摩耗説」です。生体を傷つける環境因子としては酸素、放射線、紫外線などがあります。体内損傷因子として代表的なものは酸素から作られる活性酸素です。放射線や紫外線は水と反応して活性酸素を生成します。また、遷移金属イオン(鉄イオンや銅イオンなど)、NADPHオキシダーゼ、ミトコンドリアは活性酸素の主な発生源です。人では1日に消費する酸素の3~5%が活性酸素になると言われていますが、そのうちおよそ90%の活性酸素がミトコンドリアで生成されます。
活性酸素は、反応性が非常に高いために、タンパク質、核酸(DNA、RNA)、脂質、糖質などあらゆる有機化合物と反応し、化学的な変化を加えます。それによって、タンパク質、核酸(DNA、RNA)、脂質、糖質などの構造を変化させ、機能を変化させたり、機能を失わせたり、突然変異を起こしたりします。生体には、変化した有機化合物を除去し、修復するシステムがありますが、それは完璧ではないために、修復し残した変化が蓄積し、それが老化や老化病を引き起こし、最後には死に至ると考えられています。
摩耗説の中で、近年注目されている説に「ミトコンドリアフリーラジカル説(文献2)」があります(「ミトコンドリア」について詳しくは「1-2-1)ミトコンドリアとは」を参照ください)。ミトコンドリアは細胞の活性酸素の主な(90%)産生源であるために、細胞内の他の部分に比べ活性酸素に曝される機会が多く、活性酸素によるミトコンドリアの損傷によって、ミトコンドリアの機能障害が起こることが老化の原因となるという考えから提唱されたものです(文献1、2)。正常に機能している若い細胞のミトコンドリアでは、生成した活性酸素の害からミトコンドリアを守るためにさまざまな抗酸化防御システムが備わっており、それが正常に働いているために、生じた活性酸素は消去されます。ところが、加齢などで老化した細胞のミトコンドリアでは、抗酸化防御システムの働きが低下し、それが活性酸素レベルの増加を誘導し、ミトコンドリアの酸化損傷を引き起こし、ミトコンドリアの機能を低下させると考えられています。
一方、糖化が老化の原因であるとする説があります。タンパク質のアミノ酸のアミノ基や核酸塩基のアミノ基がグルコースなどの還元糖に曝されると、お互いに反応して結合し、それらが化学的に変化して他のタンパク質や核酸と結合し架橋を形成します。このようにして生成した凝集体を糖化反応最終生成物(AGE)といいます。タンパク質の糖化は、コラーゲン、クリスタリンのような寿命の長いタンパク質で特に影響が大きくなります。糖化はグルコースの濃度が高くなるほど促進されますので、高血糖状態である糖尿病ではその影響が顕著で、糖尿病合併症の主な原因となります。また、糖化物(AGE)の蓄積によって老化や老化病が促進されます(文献2、3)。
(文献、資料)
1)「老化・寿命のサイエンス」(実験医学増刊、2013)。
2)「ハーパー・生化学」(原書29版)(丸善出版、平成25年)。
3)「老化を促進する危険因子としての糖化ストレス」(日本抗加齢医学会雑誌、2012年、Vol.8、No.1)
3)老化対策について
以上、述べてきましたように、老化の原因説として、遺伝子説と摩耗説は大変重要ですが、老化や老化病を防ぐための対策はどうすればよいでしょうか。
◎遺伝子説に対する対策
遺伝子説で現在最も重要な説はテロメア説(プログラム説の主体)と長寿遺伝子説です。
先ず、テロメアを長く保つためには、テロメアを伸長するテロメラーゼを活性化する必要があります。それと共にテロメアを傷つけ短縮させる活性酸素の害からテロメアを守る必要があります。テロメラーゼは一酸化窒素(NO)によってコントロールされていると考えられています。また、eNOS(血管内皮型一酸化窒素合成酵素。アルギニンによって活性化され、アルギニンを原料としてNOを合成する酵素)は、NOを介してテロメラーゼを活性化します。抗酸化剤は活性酸素を消去し、テロメアの短縮を防ぎます。これらのことから、eNOSを活性化してNOの生成を促進するアルギニンと抗酸化剤(特にビタミンC)の組み合わせはベストと考えられます。
また、長寿遺伝子説の観点からは、アルギニンは、一酸化窒素合成酵素(eNOS)を活性化し、一酸化窒素(NO)の生成を増やします。NOは長寿遺伝子(サーチュイン、SIRT1)を活性化してミトコンドリアの働きを高めます。活性化されたミトコンドリアは、エネルギー物質(ブドウ糖、脂肪酸、アミノ酸など)をより多く燃やして、より多くのエネルギー(ATP)を作り体の活動を高めます。また、余分なエネルギー物質(ブドウ糖、脂肪酸など)は燃やして熱として放出します。このようにして、アルギニンは、寿命を延ばし、老化、老化病、肥満、メタボリックシンドロームを強力に予防・改善します。
◎摩耗説に対する対策
摩耗説の主因として活性酸素や糖化がありますが、活性酸素は抗酸化剤によって消去されます。また、糖化はアルギニンによって強力に抑制されます(「アルギニンは糖尿病・糖尿病合併症を予防・改善します!」を参照ください)。一方、「ミトコンドリアフリーラジカル説」の観点からは、ミトコンドリアの合成を促進し、機能を高める(ATPの生成を増やし、抗酸化能を高める)ことが、老化や老化病を防ぐことにつながると考えられますが、ミトコンドリアの合成や活性化にNOは非常に重要な働きを示します。NOはアルギニンからNOSの働きで生成しますので、アルギニンは老化や老化病の抑制に有用 であると考えられます。これらのことから、摩耗説の観点からもアルギニンと抗酸化剤の組み合わせは大変重要と考えられます。
◎その他の対策
その他、アルギニンには老化の抑制や若返り、寿命延長などに働くことが期待できるどんな作用があるのでしょうか。
アルギニンは成長ホルモンの分泌を促進します。成長ホルモンはアンチエイジング効果(若返り、美肌、育毛、老化防止、肥満改善、長寿効果)が期待できる最も強力なホルモンです。アメリカでの臨床試験(人を対象にした試験)で6ヶ月の成長ホルモン治療によって10~20歳の若返り効果が証明されています。成長ホルモン療法によって、外見的な若返り(体脂肪や体重の減少、筋肉の増加、皮膚の弾力性の増大、シワの減少、皮膚のたるみの減少、毛髪の再生など)だけでなく、体の機能の若返り、すなわち、視力の改善、性的能力(精力)の向上、エネルギーレベルの上昇(元気が出て活動的になる)、病気に対する抵抗力の向上、免疫機能の向上、集中力の向上、情緒安定性の向上、記憶力や認識力の向上、血中コレステロールの改善、血圧低下、心臓機能の向上、肺機能の向上、骨密度の増加などの効果が明らかにされています。また、動物実験の結果から、成長ホルモンの注射によって平均寿命が延ばせることも示されています。このように成長ホルモンは、若返り、美肌、老化防止、肥満改善、長寿効果が期待できる夢のホルモンといえます。(最近(2004年、米国)の研究報告では少量の成長ホルモンでも肥満者の体脂肪と体重を減らすことができると報告されています)。成長ホルモン療法は実際に人を若返らせる現在唯一の方法といわれています(文献1)。
アルギニンは、閉経後の女性や高齢者において、成長ホルモンの分泌を促進しますので、若返り、美肌、老化防止、肥満改善、長寿効果が期待できます(詳しくはこちらのページをご参照下さい⇒『アルギニンは成長ホルモンを強力に増やします』)。
以上のことから、アルギニンは〔あるいは抗酸化剤(特にビタミンC、あるいはビタミンCを含めた抗酸化剤の組み合わせ)と併用して〕、老化や老化病の抑制や若返り、あるいは寿命の延長に極めて効果的と考えられます。
(文献、資料)
1)ロナルド・クラッツら原著「革命アンチエイジングー若々しく美しく元気に生きるー」(米国アンチエイジング医学会公認の完全ガイド)(西村書店、2010年)。
アルギニンは、これまで述べてきましたように(「◎アルギニンとテロメラーゼの関係」、「1-2-3)ミトコンドリアとアルギニン」、「2)摩耗説とは」などを参照ください)、老化の二大原因と考えられている遺伝子説と摩耗説の両面からアタックすることで、寿命を延長し、老化や老化病を強力に抑制し、ひいては若返りも期待できる大変な優れものです。すなわち、アルギニン(NO)は、テロメラーゼを活性化し、テロメアを長く保ちます。また、アルギニン(NO)は、長寿遺伝子(サーチュイン、SIRT1)を活性化します。さらに、アルギニン(NO)は、活性酸素や糖化を抑制します。
では、アルギニンは実際に寿命を延長したり、老化や老化病を抑制したりできるのでしょうか。これについて見てみたいと思います。
1)アルギニンの寿命延長作用
通常食で飼育しているマウスに1年間(マウスの寿命は約2年ですので1年間はほぼ半生に相当します)アルギニン(50mg/kg/日)を摂取させ、摂取終了後のマウスの生存数をアルギニン非摂取群と比較しました。その結果、アルギニン摂取群の生存数はアルギニン非摂取群に比べ14%増加しました(統計的に有意)(アルギニン摂取群の寿命は延長しました)。剖検の結果、アルギニン非摂取群に比べアルギニン摂取群では明らかに(統計的に有意に)悪性腫瘍(がん)の出現数が減少していました(「アルギニンは長期摂取によってがんの発生を少なくし生存数を増やします!」を参照ください)。
アルギニン(NO)は、テロメラーゼを活性化してテロメアを長く保ち、また、長寿遺伝子(サーチュイン、SIRT1)を活性化し、さらに、活性酸素や糖化を抑制しますので(「◎アルギニンとテロメラーゼの関係」、「1-2-3)ミトコンドリアとアルギニン」、「2)摩耗説とは」などを参照ください)、これらの働きによって、アルギニンは寿命を延長したものと考えられました。
アルギニンの寿命延長作用を、現在注目されている他の成分と比較してみましょう。TA-65は、テロメラーゼを活性化しテロメアを伸ばすとされ、大変注目されていますが、寿命を延長しないとされています(「【その他のテロメア長維持物質(特にTA-65について)】」を参照ください)。例えば、TA-65をマウス(1年齢、2年齢)に4ヶ月間投与した時、その後の生存率に影響はみられませんでした。つまり、TA-65はこの条件下では寿命延長に効果を示しませんでした。また、長寿遺伝子(サーチュイン、SIRT1)を活性化する成分であるレスベラトロールでは通常食マウスの寿命は延長しませんでした(「【その他のサーチュイン活性化物質(特にレスベラトロールについて)】」を参照ください)。
アルギニンとこれらの成分との差はどこにあるのでしょうか。恐らくは、アルギニンは、他の成分に比べ、寿命を延長するための働きがより強いか、あるいは(and/or)寿命を延長するためのより多くの、あるいはより広い作用を有しているためではないかと考えられます。
このように、寿命を延長するには、テロメア長を伸ばしたり(あるいは維持したり)、長寿遺伝子(サーチュイン、SIRT1)を活性化するだけではなく、さらに強力な付加的な作用も必要ではないかと考えられます。アルギニンには、テロメア長の伸長(あるいは維持)や長寿遺伝子の活性化以外にも、一酸化窒素(NO)を介した作用、抗糖化作用、免疫増強作用、成長ホルモン分泌促進作用など寿命や老化に関係する様々な働きを示しますので(「表.アルギニン(NO)の寿命延長、抗老化、老化病抑制作用」を参照下さい)、これらの作用が総合的に働き、他の成分と異なり、通常食の場合にも寿命を延長したものと考えられました。
アルギニンは、動物において寿命を延ばし、動物や人において老化や老化病(肥満、メタボリックシンドローム、糖尿病、糖尿病合併症、動脈硬化、心血管病、ED、高血圧症、心不全、認知症、感染症、骨粗鬆症、肝障害、痔、がんなど)を強力に予防、改善します(表)が、それには、アルギニンから生成する一酸化窒素(NO)そのものによる作用、抗糖化作用、抗酸化作用、免疫増強作用、成長ホルモン分泌促進作用など、あるいはNOによる長寿遺伝子(サーチュイン)の活性化作用(ミトコンドリア合成と活性化作用、抗酸化酵素誘導作用など)およびテロメラーゼ活性化作用(テロメア伸長・維持作用)などが関係しているものと考えられます(図)。また、アルギニン(NO)の作用は抗酸化剤によって増強されます。
一方、テロメラーゼを活性化しテロメアを伸ばすとされるTA-65や(「【その他のテロメア長維持物質(特にTA-65について)】」を参照ください)、長寿遺伝子(サーチュイン、SIRT1)を活性化することが知られているレスベラトロールは(「【その他のサーチュイン活性化物質(特にレスベラトロールについて)】」を参照ください)、アルギニンに比べると、動物や人におけるデータは乏しく、実際人において本当に効果があるかどうかは不明なのが現状です。また、安全性面でも、アルギニンがアミノ酸で生体成分であり、体にとって欠かすことのできない必須の成分であるため、長期(場合によっては一生や半生)の安全性も含め安全性面でほとんど問題ないと考えられる(実際数多くの臨床試験でアルギニンによると考えられる副作用はほとんどありませんでした(Shao A et al., Risk assessment for the amino acids taurine, L-glutamine and L-arginine. Regul Toxicol Pharmacol, 50, 376 (2008))のに対し、TA-65やレスベラトロールは体にとっては異物であるために、また、化合物としての長期安全性が確認されていないため、老化や老化病抑制のため、長期間摂取するにはまだ確認すべきことがたくさんあります(つまり、これらの成分は現時点では長期摂取は安全性面でおすすめできません)。
『つまり、アルギニンは、現時点では、総合的に考えて、他のアンチエイジング成分として注目されているもの(例えば、TA-65やレスベラトロールなど)に比べ、長寿、老化および老化病抑制のためのアンチエイジング成分として、より優れているということになると考えられます』
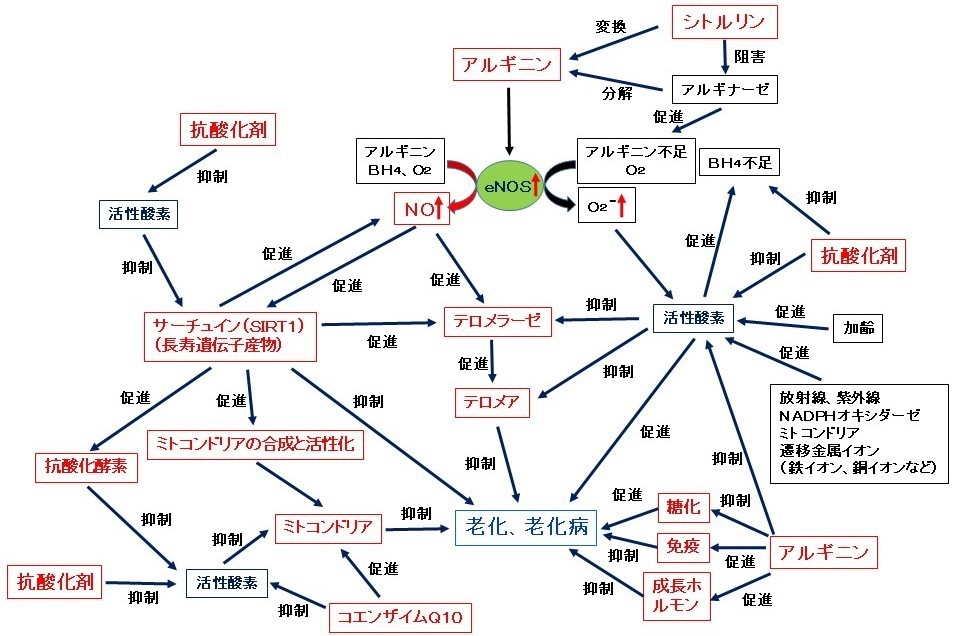
【図の説明】
アルギニンからeNOS(血管内皮型一酸化窒素合成酵素)の働きで生成したNO(一酸化窒素)は、テロメラーゼを活性化しテロメアを長くします。テロメアを長くすることで老化や老化病が抑制され、寿命が延長することが期待できます。また、NOは、長寿遺伝子からつくられるタンパク質のサーチュイン(SIRT1)の生成を促進します。サーチュインは逆にeNOSを活性化します(ポジティブフィードバック)。サーチュインを活性化することで老化や老化病が抑制され、寿命の延長が期待できます。サーチュインは、抗酸化酵素の生成を促進して酸化ストレス(活性酸素が過剰な状態)を抑制して老化や老化病を抑制します。また、サーチュインはミトコンドリアの生成と活性化を促進し、老化や老化病を抑制します。さらにサーチュインはテロメラーゼも活性化します。すなわち、アルギニンは、NOのテロメラーゼ活性化作用とサーチュイン活性化作用によって、老化や老化病(肥満、メタボリックシンドローム、高血圧、糖尿病、動脈硬化、心血管病、骨粗鬆症、認知症、がんなど)を抑制し、寿命を延長することが期待できます。
一方、加齢、放射線、紫外線、NADPHオキシダーゼ、ミトコンドリア、遷移金属(鉄イオン、銅イオンなど)などにより生成した活性酸素は、eNOSの正常な働きに必要なBH4(テトラヒドロバイオプテリン)を酸化し減少させます。BH4の不足によって、eNOSはNOを生成する代わりに活性酸素(スーパーオキシド、O2-)を生成します(eNOSアンカップリング)。そのため、抗酸化剤(ビタミンCなど)は活性酸素を消去し、BH4の減少を防ぎ、NOの生成を促進します。つまり、アルギニンと抗酸化剤は相乗的にeNOSを活性化しNOの生成を促進します。また、活性酸素はテロメラーゼ、テロメア、サーチュイン、ミトコンドリアを抑制し、老化や老化病を促進しますが、抗酸化剤の強化や抗酸化酵素を活性化することで、活性酸素の害から体を守り、老化や老化病を抑制します。このように、アルギニン単独でも老化や老化病を強力に抑制しますが、抗酸化剤を同時に摂取することでより強力に老化や老化病を抑制し、寿命(勿論健康寿命も)を延長するものと考えられます。また、ミトコンドリアの働き(エネルギー産生など)にはコエンザイムQ10が補酵素として必須ですが、コエンザイムQ10は加齢とともに体内の量が減少すると言われています(文献1)。折角アルギニンによってミトコンドリアの生成を促進してもコエンザイムQ10が不足していてはミトコンドリアは十分に働くことはできません。そのため、アルギニンと抗酸化剤だけでなく、コエンザイムQ10を共に摂取することでより強く老化や老化病を抑制することが期待できます。なお、コエンザイムQ10は抗酸化活性を持っています。コエンザイムQ10はビタミンC、ビタミンEと共に体内で強力な抗酸化ネットワークを形成しているために、体内の抗酸化能をより強化するためにも、ビタミンC、ビタミンEと共にコエンザイムQ10を摂取することが望ましいと考えられます(文献1)。
他方、老化、老化病(メタボリックシンドローム、糖尿病、高血圧、動脈硬化、心筋梗塞、脳卒中、糖尿病性血管障害、心不全、末梢血管障害、ED、がんなど)、肺動脈高血圧症、喘息、肝障害、妊娠高血圧症候群、感染症などにおいて、あるいはアルギニンの長期摂取や大量摂取(摂取量が多いほど)において、アルギナーゼという酵素が活性化されます。アルギナーゼは体内の至る所に存在しアルギニンを分解しますので、特に上記のようにアルギナーゼが活性化される場合、アルギニンの体内濃度が減少したり枯渇します。そのような場合、原料(アルギニン)不足により、eNOSはNOを生成する代わりに活性酸素(スーパーオキシド、O2-)を生成します(eNOSアンカップリング)。そのため、アルギナーゼ活性が高い場合、折角アルギニンを摂取しても、アルギニンは効果を示さないか、逆に生成した活性酸素によって体は障害を受けることになります。なお、この場合、アルギニンの効果が弱かったり示されないからといって、アルギニンの摂取量を増やしても、アルギナーゼはかえって活性化されるため逆効果になります。従って、アルギニンを老化や老化病抑制のために長期間に渡って摂取する場合、アルギナーゼ対策は必須のこととなります。シトルリンは、安全に長期間摂取できるアルギナーゼ阻害剤として近年大変注目されています。また、シトルリンは、体内でアルギニンに変換され、アルギニンとしても効果を発揮しますので、まさに一石二鳥となります。
さらに、アルギニンは、上記の働きに加えて、糖化抑制、免疫増強、成長ホルモン分泌促進などの作用を有しますが、これらの作用は若返り、老化および老化病抑制、寿命延長などに強力に働くことが期待できます。
このように、アルギニン(およびシトルリン+抗酸化剤の組み合わせ)は、若返り、長寿、抗老化、老化病抑制のための、現在最高の成分と考えられますが、それらの成分の比率や、抗酸化剤に何を組み合わせるかなどについては、最新のデータをもとに、最高のものにしなければなりません。これについては詳しくは「進化型・次世代型「スーパーアルギニンサプリメント」の開発 ーアルギニンの問題点とその克服ー」をご参照ください。
ホームページ更新情報
『代表者ごあいさつ』を更新しました。
『アルギニンは、糖尿病と糖尿病合併症の両方を予防・改善する画期的成分です!』を更新しました。
ホームページ更新情報
お気軽にお問合せください

お電話でのお問合せ・相談予約
営業時間:平日9:00~18:00(土曜、日曜、祝日、年末年始を除きます)
フォームでのお問合せ・相談予約は24時間受け付けております。お気軽にご連絡ください。
ご注意(重要)
本ホームページご利用に当たってのご注意

◎ご利用にあたって
本ホームページにおける「アルギニンの働き」を利用されるにあたり、専門家(医師、看護師、薬剤師)にご相談されることを強くお勧めします(弊社薬剤師または看護師にご気軽にご相談ください。)。
◎本ホームページの目的および引用データについて
本ホームページは、世界的に発表されたアルギニンの最新文献をもとに、アルギニンの最新情報をお届けするものです。そのためそれらのデータに関する最終責任は該文献著者に存在します(引用文献として示してあります)。データに関する疑義は弊社または該文献著者にお問い合わせください。

